博文
动物体内氢气释放规律研究方法
||
动物体内氢气释放规律研究方法
点评:经典的看法认为,氢气并不能被动物组织细胞代谢,可以被体内微生物分解,随着氢气生物医学研究的推进,人们逐渐对真核细胞代谢氢气的问题有了不同看法。也许氢气可以被真核细胞代谢分解。如果是这样,氢气在身体内的代谢动力学规律就比较复杂了,研究起来也相对麻烦。因为氢气进入身体内,有一部分被组织细胞分解,有一部分被组织细胞物理结合,有一部分被微生物代谢分解,大部分随着血液循环在身体内运动,经过肺呼吸交换和皮肤空气界面的气体交换等途径释放到环境中。无论经过何种途径,只要气体离开身体,就会在环境中扩散。把机体密闭在一个不会泄露氢气的环境中,对这个环境中氢气浓度进行实时分析,就可以对机体释放氢气的规律进行研究。这应该是一个比较好的研究氢气代谢动力学的方法。这种方法也是最经典的代谢研究技术。但普通的代谢研究设备可能没有考虑到氢气非常容易泄露的特点,不符合氢气代谢研究的基本要求。
背景
氢气(H2)是由肠道微生物群通过饮食碳水化合物的发酵内源性产生的。在过去的几年中,大量研究已经证明了氢气在各种病理生理环境中具有显著的治疗潜力,这使得对其在实验室物种中的产生特性的研究具有重要的临床前重要性。
方法
本研究提出了一种创新解决方案,以准确监测自由活动的啮齿类动物中氢气的产生,同时尊重动物福利标准。开发的装置包括一个放置在气密室内的金属啮齿类动物笼,其中空气质量得到维持,并且连续分析氢气浓度。在检查了用于控制和维护气密室内空气质量系统的密闭性和效率之后,对不同代谢表型的大鼠和小鼠进行了测试,实验时间为12分钟至1小时不等,并反复进行。使用基于一阶移动平均的简单计算算法获得氢气产生率(HPR)。
结果
发现高食量Zucker大鼠的HPR是对照Wistar大鼠的两倍,分别为每只动物2.64和1.27 nmol.s−1。此外,摄入菊粉(一种饮食纤维)刺激了小鼠中氢气的产生。对于接受对照饮食的动物,HPR为0.46 nmol.s−1,而对于接受菊粉饮食的动物,HPR为1.99 nmol.s−1。
结论
所提出的装置结合我们的算法使得能够精细分析实验室大鼠或小鼠的代谢表型,特别是关于它们的内源性氢气产生。
1 前言
氢气(H2),更常被称为分子氢,是宇宙中最丰富的分子。在地球上,氢气是在地壳深处的橄榄石中通过高温产生的,可以作为人类活动的潜在能源来源。1, 2动物也能产生氢气。动物肠道微生物群含有某些可以通过碳水化合物的氢酶介导发酵产生氢气的微生物种类。这些微生物在哺乳动物消化道中的活动是如此之大,据估计人类微生物群每天能够产生超过1升的氢气。3
肠道中产生的氢气有三种可能的结果:(1)它可以直接随肠道气体排出;(2)它可以被产甲烷细菌的能量代谢消耗;(3)它以溶解形式穿过肠上皮细胞,扩散到内部环境中,分布在全身,最后主要通过肺部排出。它也可以通过皮肤4或尿液5较少程度地排出。在临床实践中,呼出的氢气已被用于70多年的时间,作为一种简便的诊断碳水化合物吸收不良的方法,例如乳糖不耐受症。6最近,“呼吸测试”的使用已扩展到对肠道菌群失调的诊断,其对许多慢性疾病的贡獮正在成为越来越多出版物的主题。7, 8对于这些所谓的呼吸测试,已经开发并可用于临床版本的几种工具。
在过去的15年中,大量的实验和临床研究已经证明了(i)微生物群与健康之间的联系9, 10(ii)氢气监测反映了肠道微生物群的组成和活性,以及(iii)氢气与其抗氧化、抗炎和抗凋亡特性相关的治疗潜力。11-13毒理学和药理学研究已证明氢气的安全性14,我们最近还证明了其在大鼠体内无基因毒性。15现在越来越有必要开发测量啮齿类动物呼出氢气的工具,以便进行与这些新兴概念相适应的相关临床前方法。为实验室啮齿类动物开发满意的氢气呼吸测试工具的主要障碍是无法从未经麻醉的实验室啮齿类动物收集呼出气体样本。16解决在有意识的动物中收集空气样本问题的第一个提议由Gumbmann和Williams提出。17这个小组开创了一种使用非侵入性程序测量大鼠呼出氢气的方法,用于在不同营养干预下重复测试同一只动物。动物被放置在直径为20厘米的碗形干燥器中。每小时收集1毫升包含积累的氢气的空气样本,并使用气相色谱进行分析。继这项首次研究之后,几位作者提出了同一设置的优化方案,都是基于定时收集,并且在动物福利方面并不总是完全令人满意。18-21
直到现在,现有系统中没有一个结合了动物福利的伦理方面和实时准确监测动物呼出氢气流量的系统。本研究的目的是开发并验证一种原创的临床前设备,该设备结合了生理和伦理特点,并能够连续监测实验室啮齿类动物呼出的氢气。为了验证阶段,我们选择了具有不同代谢表型的大鼠和小鼠,这些表型可能会影响呼出空气中的氢气含量,以此来挑战我们设备的敏感性和稳健性。
2 方法
2.1 设备设置
提出的氢气监测设备如图1所示。它由一个气密舱室(玻璃干燥器,总内部体积9.4升)组成,在其中放置了一个内部体积为8.1升的网格笼以容纳动物。舱室内放置了两个标准的92毫米风扇,以均匀空气而不干扰动物。为此,第一个风扇装配了支架以侧向引导气流,第二个放置在笼子下方以确保向下的空气流动。
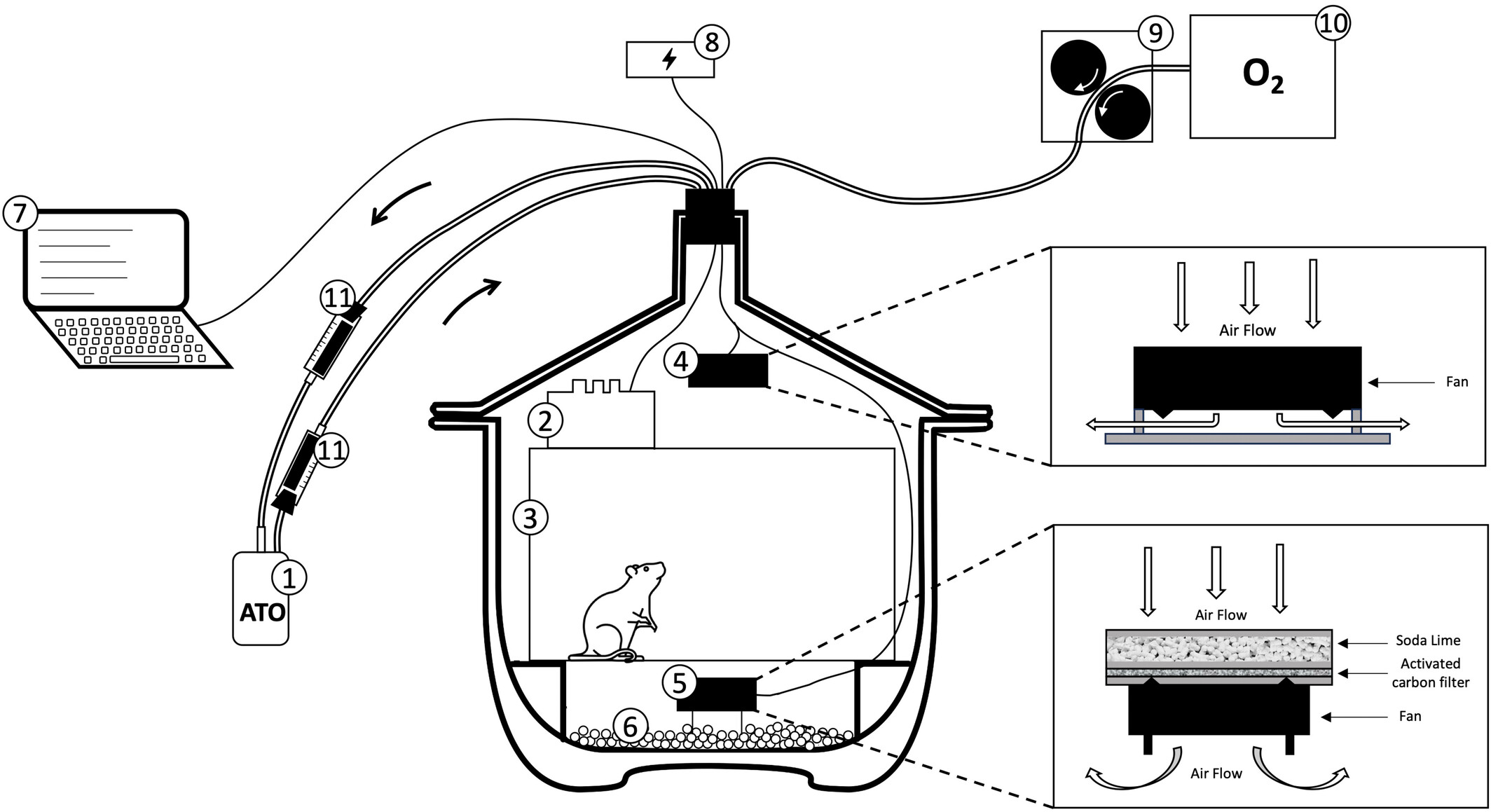
图1氢气监测装置的全局视图:(1)氢气传感器ATO SKY 2000,(2)多传感器(氧气、二氧化碳、相对湿度和温度),(3)笼子,(4)上部风扇,(5)与二氧化碳吸收系统(苏打石灰)耦合的下部风扇,(6)水蒸气吸收器(硅胶),(7)数据采集,(8)电源,(9)蠕动泵,(10)氧气容器,以及(11)活性碳过滤器。二氧化碳和水蒸气是由细胞代谢生理产生的。因此,当动物被放置在一个密闭的封闭空间时,二氧化碳会迅速积累,空气变得湿润。二氧化碳是一种窒息性和有毒气体,湿度可能会损坏设备的传感器。为了将二氧化碳维持在大气范围内——大约500 ppm——在下部风扇上方的碳过滤器上放置了175克苏打石灰(Spherasorb Intersurgical)。通过在舱底添加150克硅胶来防止水蒸气的积累。一个包含2升氧气的密封特氟隆袋(由525 KS Drive Devilbiss浓缩器产生)连接到一个蠕动泵,该泵通过一条1/1.8毫米的聚乙烯管连接到舱室,允许控制向动物供应氧气。氧气和二氧化碳水平,以及相对湿度和温度,使用安装在笼子顶部的一个自制优化多传感器探测器在舱室内持续测量。传感器(DFROBOT:SEN0322用于氧气,SEN0159用于二氧化碳,以及SEN0137用于相对湿度和温度)被安装在一个板上,并由一个开源微控制器(Arduino)管理。数据获取由Arduino处理,并通过USB端口传输到PC软件。该软件以1 Hz的频率将三个传感器的数据记录在SD卡上。在整个实验过程中,监测了氧气和二氧化碳浓度、温度以及相对湿度。两个氢气气体探测器,“SKY2000”,购自美国ATO公司。对于大鼠测量使用了“ATO 500”(范围0-500 ppm,检测阈值1.6 ppm,准确度0.1 ppm),而对于小鼠则使用了“ATO 100”(范围0-100 ppm,检测阈值0.25 ppm,准确度0.1 ppm)。在使用前,ATO氢气传感器已经针对Quintron BreathTracker进行了校准,用作参考。ATO氢气传感器放置在旁路上,其泵设定为22.5 L/h,以确保旁路内的空气流动。两个含有活性碳过滤器的50毫升注射器放置在旁路的进、出口处,以捕获污染气体——主要是氨气——并减少泵噪音在舱内的传递。所有电线(电源和数据采集)和管道(氧气输入和氢气测量旁路线)都通过一个橡胶塞子穿过,该塞子密封地封闭了舱盖。
2.2 动物实验
2.2.1 伦理问题
在设计和开发新的临床前设备时,动物福利是一个日益受到关注的问题。本文中涉及的动物实验仅限于对有意识动物进行的非侵入性探索。此外,本研究中包括的动物是之前协议中的重用动物,以符合三个R原则(替代、减少、改善)。所有实验均按照欧洲共同体理事会指令2010/63/EU(2010)进行。大鼠是在之前由法国研究部授权的两个程序后重用的,参考编号分别为#36969–202204251517299(8周龄雄性Wistar大鼠,平均体重=258±12克,n=6)和#38828-2022091611584664(8-10周龄雄性Zucker [fa/fa]大鼠,平均体重=538±38克,n=6)。在小鼠实验中,41周龄的C57BL/6雌性小鼠(n=24,30-35克)是从早期研究(#26300-2020070111383424)中重用的,其中12只小鼠在饮用水中补充了Orafti GR菊粉(Beneo)(72 g/L),为期41周,而另外12只(对照组)在同一时期接受了常规水。
2.2.2 监测装置中氢气浓度
大鼠在不同时间被单独放置在实验装置中,跟踪氢气产生1小时。研究的两组小鼠被分为两批,每批六只小鼠进行氢气测量。每批六只小鼠测量12分钟。每天两次进行测量,分别在上午7点和下午1点。
2.3 数据分析
开发了一个简单的计算算法来确定从装置中连续测量的氢气浓度得出的氢气产生率(HPR)(图2)。首先将氢气产生曲线从百万分之一转换为随时间的纳摩尔氢气。原始数据以百万分之一表示,首先乘以封闭空间的体积(Ve = 9.4 L)将其转换为微升。考虑到氢气在标准环境温度和压力下为理想气体,通过除以24.5 L(1 mol气体的体积)并乘以1000将数据转换为纳摩尔。然后通过对一个10点滑动窗口执行一阶移动平均(MA[1])来处理纳摩尔氢气数据集。HPR(以nmol.s−1表示)计算为纳摩尔氢气数据集作为在舱内花费时间的线性回归的斜率,从第一个非零点开始。
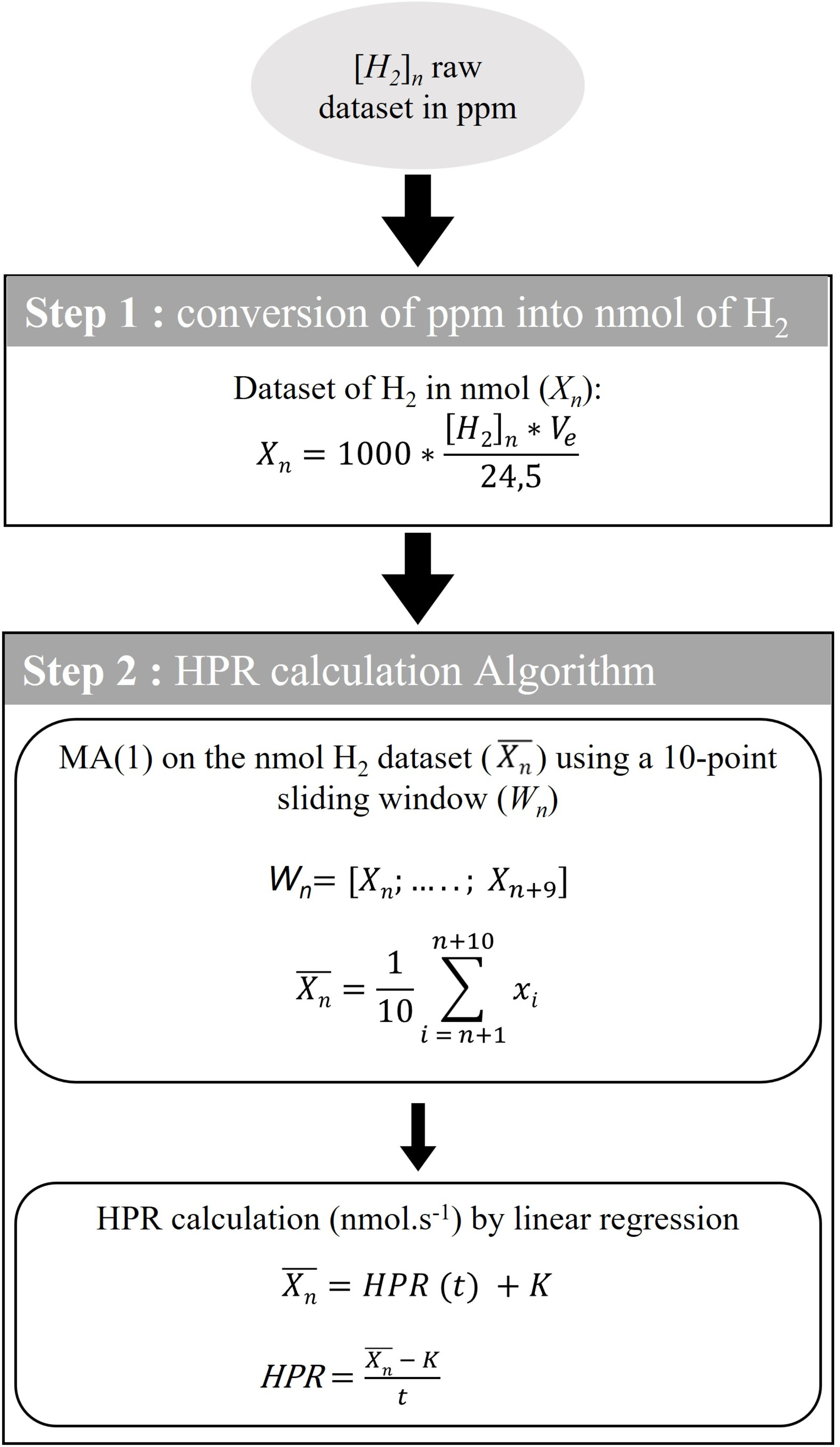
图2 氢气产生率(HPR)计算的数据处理。传感器给出的氢气浓度原始数据集([H2]n)首先从百万分之一转换为纳摩尔,考虑到在标准环境温度和压力下1 mol氢气的体积为24.5 L。然后,通过对一个10点滑动窗口(Wn)执行一阶移动平均(MA[1])来处理纳摩尔氢气数据集(Xn)。以纳摩尔每秒(nmol.s−1)表示的HPR计算为MA(1)纳摩尔氢气数据集(????¯)作为在舱内所花费时间(t)的线性回归的斜率,从第一个非零点开始。Ve:封闭空间体积(9.4 L)。
2.4 统计学
使用配对t检验来统计比较Wistar大鼠在上午和下午的HPR。使用独立t检验来统计比较Zucker大鼠与Wistar大鼠的HPR。
3 结果
3.1 设备特性和空气质量控制
通过监测在舱内注入50、100或200 ppm氢气后氢气浓度的稳定性来研究设备的气密性(图1)(图3A)。在注射时氢气浓度迅速增加,并因设备中气体均匀化而略微短暂下降后,氢气达到了一个平台期。
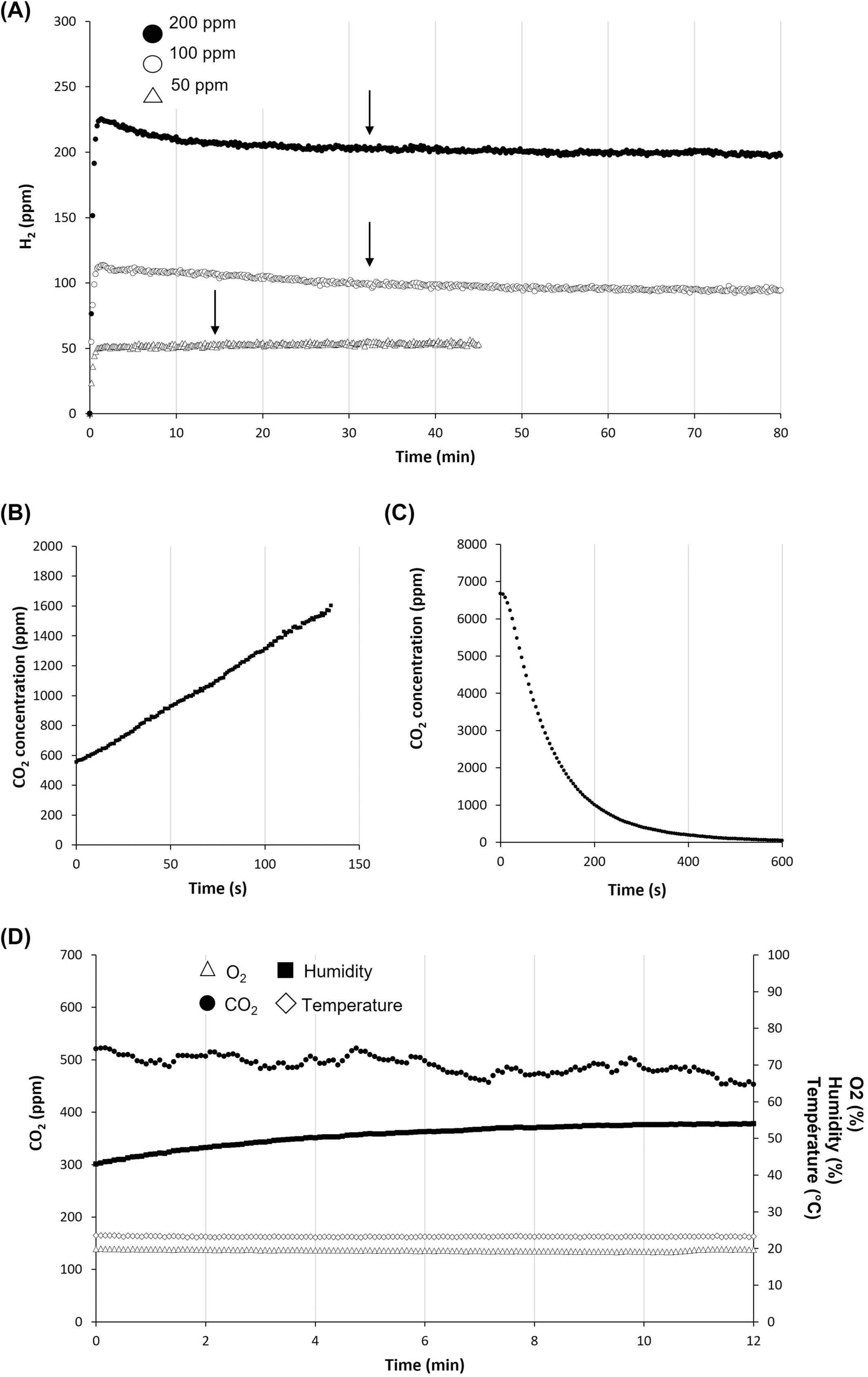
图3 监测氢气设备表征。(A) 氢气泄漏测试。在密封室中注射200(黑圈)、100(空圈)或50 ppm的氢气后连续记录。箭头对应于稳态开始的时间。(B)在没有苏打石灰的情况下,对老鼠进行CO2测量。(C)在存在200毫升苏打石灰的情况下,人类呼入空气的CO2被吸收到室内。(D)室内环境参数。O2(空三角)、CO2(黑圈)、湿度(黑色方块)和温度(空菱形)在六只C57BL/6小鼠存在下测量了1小时。
一只体重为260克的大鼠的CO2产生量通过室内移除苏打石灰后的CO2探测器测量了2分钟。该大鼠产生了3.1 μmol/s的CO2(图3B)。通过增加室内CO2浓度至>6000 ppm来测试CO2吸收系统的CO2吸收能力。观察到的装置中最大CO2吸收速率为18.4 μmol/s(图3C)。
室内空气组成由小鼠监测(图3D)。通过调整蠕动泵的流量以适应即时O2值,手动维持室内O2含量在19%至23%之间。实验确认了CO2吸收系统的效率,因为CO2浓度维持在正常的大气浓度500 ppm左右(平台值:490±17 ppm;图3D)。最后,由于硅胶的作用,相对湿度保持在80%以下,而温度在整个实验过程中保持恒定(图3D)。
3.2 在暴饮暴食大鼠中增加的HPR
在对照组和暴饮暴食大鼠中,氢气的产生在调查的一小时内几乎是稳定的(图4A)。这使我们能够按照第2.3节所述确定HPR。
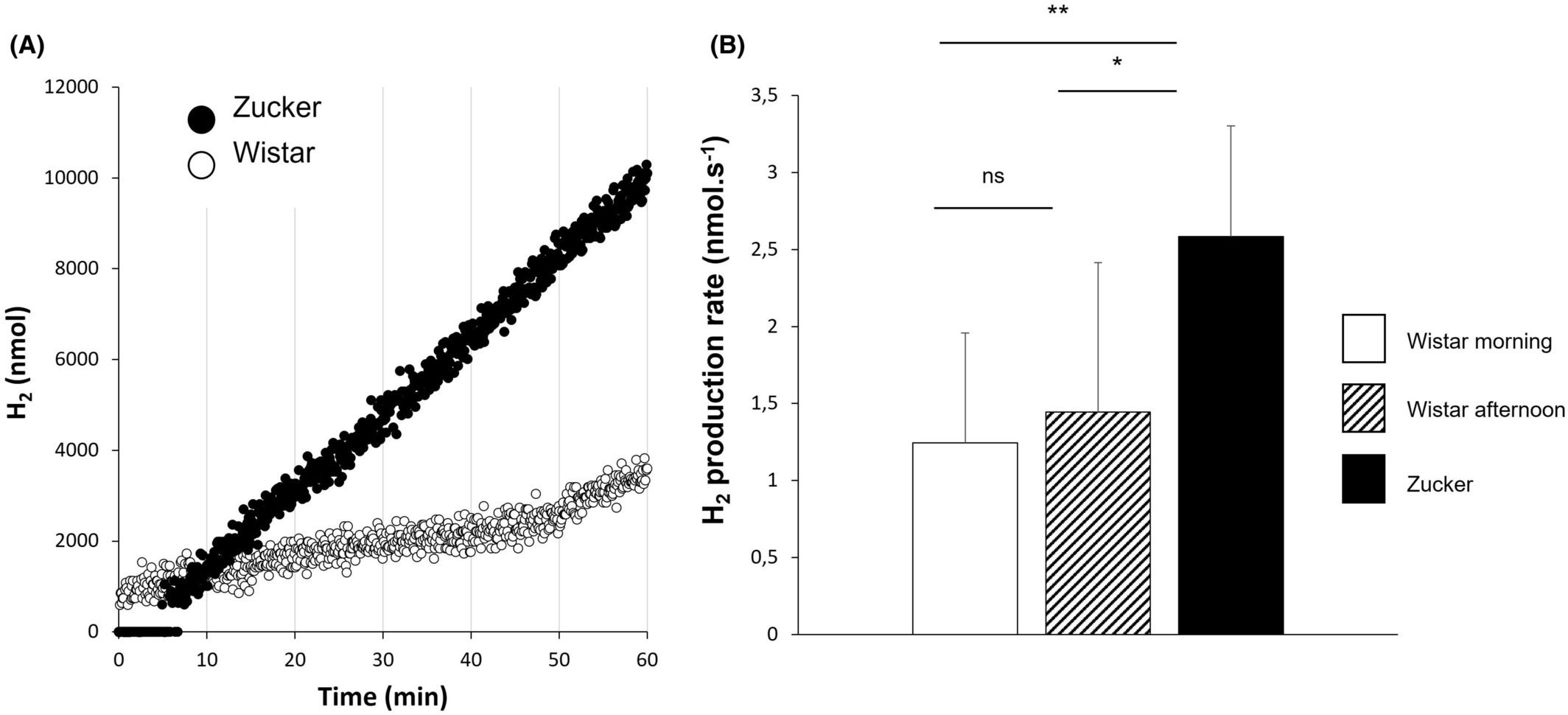
图4大鼠氢气产生率(HPR)监测。(A)一只Zucker大鼠(黑色圆圈)和一只Wistar大鼠(空心圆圈)在1小时内测量的氢气产生原始数据。(B)Wistar大鼠在上午(空心柱,n=6)或下午(斜线柱,n=6)测量的HPR,以及Zucker大鼠(黑色柱,n=6)的HPR。进行了配对和独立t检验,*p值<0.05,**p值<0.01。数据以平均值±标准差(SD)表示。 在对照Wistar大鼠中,上午和下午测量的平均HPR没有显著差异,上午为1.25±0.71 nmol.s−1,下午为1.44±1.00 nmol.s−1(图4B)。然而,无论是在上午还是下午测量的多食性Zucker大鼠的HPR,2.58±0.72 nmol.s−1,平均都是同龄对照Wistar大鼠的两倍,p<0.01(图4B)。
3.3 菊粉补充导致小鼠昼夜周期内氢气产生率(HPR)的循环增加
在小鼠研究中,氢气产生率(HPR)是在单个动物以及每批六只动物上测量的。这两种方法都能够在测量时间足够的情况下确定HPR。我们的计算算法被证明足够稳健,能够确定单个对照C57BL/6小鼠在设备中放置1小时后的极低HPR(HPR = 5.60 10−2 nmol.s−1;图5A)。
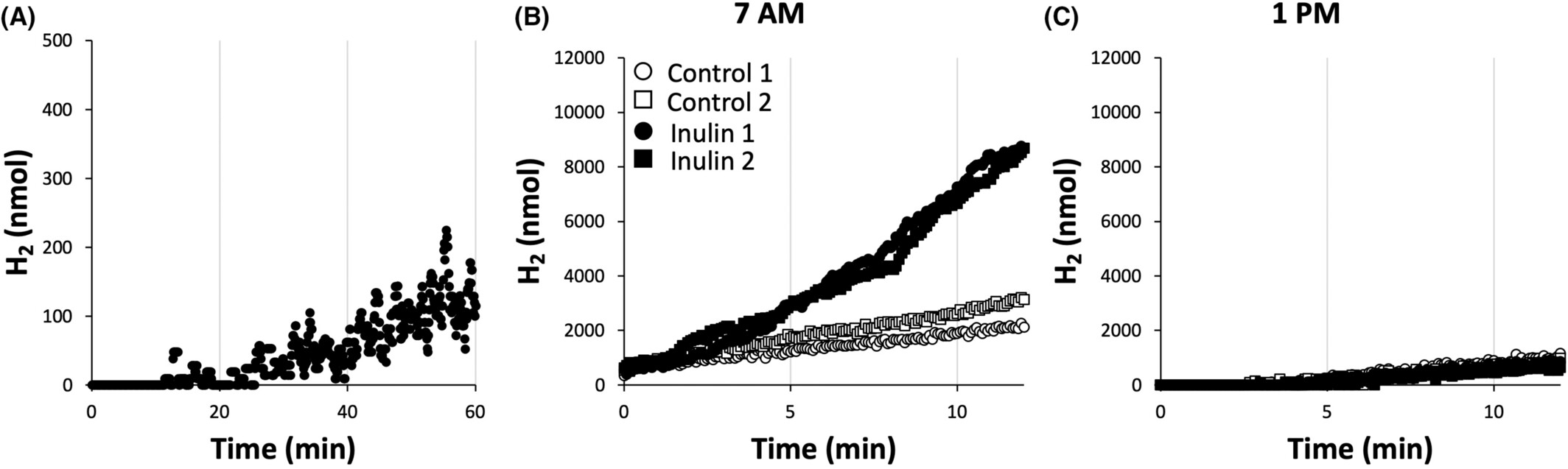
图5小鼠中氢气产生率(HPR)的监测。(A)一只C57BL/6对照小鼠的氢气产生的一阶移动平均值。数据处理在材料和方法部分有描述。(B)两批六只对照C57BL/6小鼠(空心圆圈和方块)或两批六只随意补充72 g.L−1菊粉的C57BL/6小鼠(黑色圆圈和方块)在上午7点到8:30之间的氢气产生原始数据。(C)两批六只对照C57BL/6小鼠(空心圆圈和方块)或两批六只随意补充72 g.L−1菊粉的C57BL/6小鼠(黑色圆圈和方块)在下午1点到2:30之间的氢气产生原始数据。
对于在小鼠批次上进行的测量,观察到长期用菊粉治疗41周的动物的HPR随时间的大幅变化,而在年龄匹配的对照小鼠中这种日常变化最小。因此,早上7点测量的整体HPR(一批六只小鼠)在两批菊粉补充小鼠中为8.7 ± 3.4 nmol.s−1(即每只小鼠标准化HPR = 1.45 ± 0.57 nmol.s−1),在两批对照批次中为2.8 ± 0.9 nmol.s−1(即每只小鼠标准化HPR = 0.47 ± 0.15 nmol.s−1;图5B)。相反,下午1点的整体HPR在两批菊粉批次中为1.5 ± 0.32 nmol.s−1(即每只小鼠标准化HPR = 0.25 ± 0.05 nmol.s−1),在两批对照批次中为1.5 ± 0.1 nmol.s−1(即每只小鼠标准化HPR = 0.25 ± 0.02 nmol.s−1;图5C)。
为了完善小鼠的营养方法,两批治疗了41周的菊粉在24小时内被撤回(图6A)。计算得出的菊粉和对照批次小鼠的HPR在一天中的任何时间都非常相似(四个批次的整体HPR:早上7点为2.0 ± 0.5 nmol.s−1,即每只小鼠标准化HPR = 0.33 ± 0.08 nmol.s−1,下午1点为2.0 ± 0.4 nmol.s−1,即每只小鼠标准化HPR = 0.33 ± 0.07 nmol.s−1)。然后所有实验组(对照和菊粉)的饮用水在接下来的24小时内补充了菊粉(72 g.L−1)。两个合并的小鼠组在早上7点的HPR为11.7 ± 3.2 nmol.s−1(即每只小鼠标准化HPR = 1.95 ± 0.53 nmol.s−1),下午1点为1.6 ± 0.4 nmol.s−1(即每只小鼠标准化HPR = 0.27 ± 0.07 nmol.s−1)(图6B)。
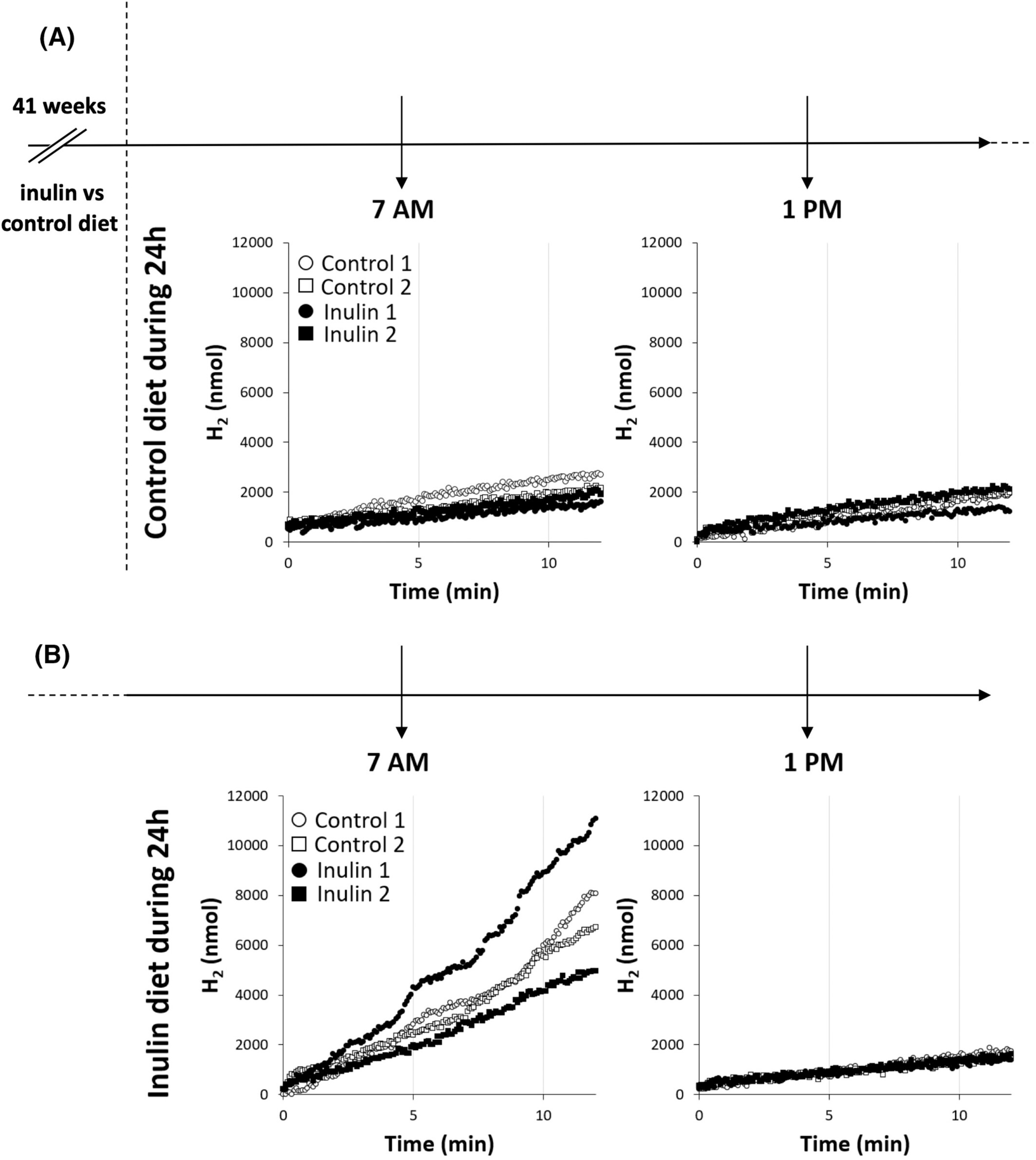
图6菊粉诱导的氢气产生监测。(A)喂食对照饮食(对照1和2,空心圆圈和方块)或补充菊粉(菊粉1和2,黑色圆圈和方块)41周的小鼠,在24小时内接受对照饮食,期间在上午7点到8:30和下午1点到2:30之间各测量一次氢气产生,每次持续12分钟。(B)喂食对照饮食(对照1和2,空心圆圈和方块)或补充菊粉(菊粉1和2,黑色圆圈和方块)41周的小鼠,在24小时内接受对照饮食,然后在接下来24小时内补充菊粉(72 g.L−1)。在这24小时菊粉补充期间,氢气产生在上午7点到8:30和下午1点到2:30之间各测量一次,每次持续12分钟。
4 讨论
本工作中开发的临床前设备达到了最初定义的目标。首先,它提供了一个新的生理变量,即HPR,并提出了一个计算算法,使其能够稳健地确定。其次,提出的新系统允许在令人满意的道德条件下进行生理测量,保证动物的身体完整性和福祉。此外,本研究中提出的实验验证研究是在之前协议的动物上进行的,以遵守三R原则。最后,我们提供了一些临床前情况的例子,在这些情况下我们的设备成功地通过测量它们的HPR来表征具有不同实验表型的啮齿类动物。
所有之前尝试在临床前研究中测量氢气产生的尝试都基于定时收集方法,要么是非常有限的空气样本数量,要么甚至只有一个。我们的设备允许在气密封闭环境中连续测量氢气积累,采集频率为0.2Hz。从传感器产生的原始数据中,一个简单的计算算法提供了一个对应于氢气随时间累积一阶移动平均斜率的HPR值。这种方法提高了测量的稳健性和准确性。
该设备由一个密封良好的封闭环境组成,动物在其中被限制在采集期间。在整个测量期间,动物所处的环境变量得到了完美控制,特别是空气中氧气、二氧化碳和其他污染物气体的成分、温度、压力、湿度和噪音水平。
为了证明我们设备在使用时的适用性,我们首先在一种肥胖大鼠模型上进行了HPR测量。我们的临床前设备证明,Zucker大鼠的HPR是同龄瘦型Wistar大鼠的两倍。Zucker大鼠携带编码瘦素受体的基因突变,使它们变得贪食。10周龄时,雄性Zucker大鼠已经肥胖并患有糖尿病,每天的食物摄入量为30克,几乎比同龄瘦鼠多出35%。此外,与瘦鼠相比,Zucker大鼠的微生物群显示出一些特殊性,包括富集了Bacteroidota和Bacillota细菌门。令人惊讶的是,测得的Zucker大鼠HPR增加(50%)超过了食物摄入量的增加(35%)。我们认为这两种现象之间的不成比例是由于Zucker大鼠表型特征性结肠微生物群的定性变化,因为Bacteroidota和Bacillota是高产氢气的细菌门。需要进一步的研究来验证这一假设。然而,这项研究表明我们的系统可以准确评估单个大鼠在1小时测量内的HPR。此外,通过将一只小鼠放入我们的设备中,我们进一步证明了使用我们开发的计算算法,还可以在一小时内量化非常低的HPR值。实际上,如果考虑到ATO 100传感器的准确性(0.1 ppm)和检测阈值(0.25 ppm),我们可以估计在1小时测量中使用我们的算法设备的灵敏度极限为4 10−2 nmol.s−1(0.1 + 0.25 = 0.35 ppm.h−1 = 10−4 ppm.s−1 = 4 10−2 nmol.s−1)。单只动物测量为实验室动物在微生物群研究中的精确和非侵入性表型鉴定铺平了道路。
在某些使用条件下,对六只小鼠进行表型分批测量可能比单只动物测量更有优势,因为它能够在不超过12分钟的快速测量中获得平均HPR值。通过这种方法,我们能够确定低至每只小鼠0.2 nmol.s−1的标准化HPR,这是现有设备无法达到的值。因此,对一批小鼠进行整体HPR测量可以是一个重要的资产,例如,用于快速确定营养干预或药物治疗的效果,而不降低生理测量的质量。
为了进一步证明我们设备的有效性和灵活性,我们选择对小鼠实施营养操纵。在这一特定背景下,所提出的临床前设备揭示了在摄入菊粉后的特定时间内氢气产生受到刺激。菊粉是一种主要存在于植物根部的饮食纤维,具有益生元活性。其被结肠菌群水解释放果糖,然后被某些产氢气的微生物物种利用。菊粉可以用于氢气呼气测试和诊断果聚糖不耐受。我们的小组和其他小组已经证明,除了刺激肠道中氢气的产生外,富含菊粉的饮食还能够调节肠道微生物群的组成。最近使用荧光标记物研究了小鼠中菊粉的消化过程,证明其结肠消化阶段在摄入后2小时开始,并在4.5小时后达到高峰。因此,可以预期在摄入菊粉后4.5小时会出现氢气产生的峰值。由于小鼠是半夜行性啮齿类动物,它们主要在夜间进食和饮水。因此,饮用水中补充菊粉的小鼠的氢气产生应在清晨达到高峰,并在一天结束时降至最低。我们的结果如预期所示,在早上7点,补充菊粉的小鼠的标准化每只小鼠HPR比喂食对照饮食的小鼠高出三倍多。同样如预期,在下午1点,即远离食物和饮水摄入的时间,补充菊粉的小鼠的标准化每只小鼠HPR很低,接近于对照小鼠测得的水平。由于菊粉促进肠道微生物群中特定细菌的生长,我们可以推测,长期用菊粉处理的小鼠与对照小鼠之间HPR的差异主要源于微生物群的组成。为了解决这一问题,在HPR测量前24小时中断了菊粉的慢性补充。有趣的是,两个实验组都显示出等效且低水平的HPR。在HPR测量后立即,两组实验小鼠在接下来的24小时内都接受了富含菊粉的饮用水。这一实验的第二阶段对应于菊粉补充组小鼠慢性治疗的恢复和对照组小鼠的急性治疗。在早上7点评估的HPR在两组中相同,并且比前一天测量的基础值高出五倍。此外,在实验的这一阶段获得的HPR值与治疗中断前在菊粉补充组中获得的值相当。当在下午1点测量HPR时,两组中的HPR都显著降低到基础水平,如之前在菊粉补充组中观察到的那样。
总的来说,我们在操作性临床前条件下进行的测量表明,所提出的设备可以在不同啮齿类物种和各种生理条件下获取准确数据。其高灵敏度使得能够准确评估小型实验动物的氢气产生率,即使是非常低的水平。最后,我们的设备能够直接确定单个和成组动物在短测量期内的HPR。
5 结论
本研究证明了我们设备的有效性、稳健性和灵敏度,该设备能够在各种临床前条件下监测实验室啮齿类动物的HPR。我们的验证研究证明了HPR作为对肠道微生物群表型的初步探索方法在营养模型和特定基因型动物中的相关性。实施额外的传感器来监测其他呼出气体可以进一步增强设备在完全非侵入性表型分析实验室动物背景下的相关性。提出设备的使用也可以扩展到新的氢疗法治疗或设备的发展与特征描述,这是一个目前非常有前景的领域,特别是对于治疗炎症性疾病或具有强烈氧化成分的疾病。
https://blog.sciencenet.cn/blog-41174-1440206.html
上一篇:衰老神经元驱动的大脑衰老
下一篇:果糖和高尿酸血症