博文
氢气水缓解酒精诱导氧化损伤的实验
|
本论文作者来自神户学院大学药学部药物递送系统实验室
点评:这个研究并不是解酒,而是长期饮酒导致的肝脏氧化损伤和线粒体功能紊乱。对应于人类,类似长期饮酒导致的肝脏损伤。当然这是动物实验研究,不能等价于人类的效应。但可以作为人类酒精脂肪肝研究的前期基础,逻辑上也可能能产生作用。关于氧化还原的损伤,今天的生物医学仍然存在许多未知。例如酒精本身是典型的还原剂,但饮用酒精仍然能导致肝脏损伤和氧化应激。氢气虽然并不能直接破坏和分解酒精,但能让酒精导致的肝脏损伤得到缓解,虽然我们对这种效应的分子基础不非常了解。但一种还原剂能缓解另外一种还原剂的伤害,这仍然是让人感到困惑的。
超细气泡(UFBs),即直径小于1微米的气泡,由于布朗运动的影响,它们在液体中能够稳定存在,这一点已得到广泛认可。在本研究中,我们专注于具有抗氧化潜力的氢气,并探索了装有氢气的H2填充超细气泡的功能,以确定它们作为活性气体向生物体递送的口服载体的潜在用途。为此,给大鼠口服乙醇以诱导肝脏氧化应激,并评估饮用装有氢气的超细气泡(H2 NanoGAS®)水两周对减少氧化应激的效果。连续饮酒被发现显著增加了对照组血脂过氧化水平,确认了氧化应激的诱导。通过饮用浓缩H2 NanoGAS®(C-HN)水,显著抑制了血脂过氧化的增加。此外,测量肝脏线粒体活动显示,饮用H2 NanoGAS®水有助于维持正常水平和/或增强受乙醇摄入影响的线粒体电子传递系统的功能活动。据我们所知,这项研究首次提供了证据,证明口服摄入的超细气泡可以作为将气体递送到组织的载体,从而在体内发挥其生理活性。我们的发现突出了超细气泡应用于各种生理活性气体的潜力,以及它们在未来医学领域的利用。
引言
超细气泡(UFBs)因其在液体中的稳定性而广为人知,这归功于布朗运动的影响,显示出由于其细微性而不受浮力影响的能力。1) 这些气泡中的气体可以根据其应用进行选择,使UFBs在各种领域都具有吸引力。目前,UFBs正在包括医学2)、农业3,4)、卫生5)、食品科学6,7)和营养8)在内的各个科学领域中被研究。特别是,由于UFBs的稳定性和安全性,它们在医学应用中显示出显著的潜力。2,9) 然而,关于这些领域使用的研究仍处于起步阶段。尽管氢气10)、氧气11)和一氧化氮12)是具有生理活性的气体,但由于需要复杂的设备和专门的仪器来生产它们,它们在生物体中的使用变得复杂。生成和使用这些气体的复杂性和局限性使得这些气体的生物医学应用不太方便。相比之下,使用UFBs封装这些气体可以通过摄取的方式管理生物活性气体,从而便于它们在生物体中的使用。然而,很少有研究详细检查了使用封装在这些气体中的UFBs的气体在体内的生物活性效果。因此,在这项研究中,我们专注于已知具有抗氧化潜力的氢气,并研究了装有氢气的H2填充超细气泡封装氢气的功能,以评估它们作为将生物活性气体递送到生物体的载体的实用性。
氢气是一种具有强还原能力的气体,由于其对生物体的无毒性以及其对抗氧化应激的细胞保护作用,它具有生物活性效应,可作为治疗和预防性抗氧化剂。13,14) 有报告表明,氢气可以去除乙醇诱导的活性氧物种(ROS)15) 并减轻线粒体功能障碍。16) 在大鼠中,口服氢水已被报告可以保护海马神经元和线粒体免受氧化应激。因此,它被认为是医学领域的一种非常有价值的气体。目前,生物体摄取氢气的最常见方法是通过饱和氢水,其中氢气被溶解至饱和并储存。尽管这是一种常见的方法,但保持水中溶解氢的浓度是困难的。在常温常压下,其半衰期约为两小时,由于稳定性低,不适合一般分销。因此,我们专注于可以长时间稳定保留气体的超细气泡。在这种情况下,我们假设如果可以通过含有H2填充超细气泡的水口服摄取氢气,那么可以以简单的方式在生物体中诱导氢气的抗氧化效果。
为了验证这一假设,我们使用了一个大鼠模型,通过乙醇诱导氧化应激,以阐明超细气泡作为具有抗氧化特性的氢气口服载体的实用性。实验大鼠被提供了含有H2填充超细气泡的水长达一段时间,并通过测量血液和肝脏中与氧化应激相关的生物标志物水平来评估含H2填充超细气泡水减少氧化应激的效果,这些生物标志物即超氧化物歧化酶(SOD)样活性和丙二醛(MDA)水平。此外,由于MDA结果显示在研究过程中肝脏氧化应激减少,进行了线粒体呼吸测量以评估H2填充超细气泡对肝脏线粒体功能的影响。如果在摄入含H2填充超细气泡水后观察到生物体中有利效果,如氧化应激减少,超细气泡作为传统上不方便的生物活性气体的新型递送载体的实用性将变得显而易见。
材料和方法
材料
使用旋转剪切法生产的含H2填充超细气泡(H2 NanoGAS®)水。H2 NanoGAS®水由Shinbiosis公司(大阪,日本)提供。通过使用旋转蒸发器(东京理化器械株式会社,东京,日本)将H2 NanoGAS®水浓缩10倍来制备浓缩H2 NanoGAS®水。水浴温度为45°C,冷却水温度设定为3-7°C。压缩压力设定为-1MPa,转速为126rpm。H2 NanoGAS®水的平均大小和数量分别为124.3±6.8nm和0.16±0.05×10^8/mL(平均值±标准误差),对于浓缩H2 NanoGAS®水,这些值分别为112.5±8.4nm和5.12±0.96×10^8/mL(平均值±标准误差)。这些数据通过使用NanoSight NS300(马尔文帕纳蒂凯有限公司,英国伍斯特郡)进行纳米颗粒追踪分析(图1)。考虑到超细气泡颗粒的大小和数量,H2 NanoGAS®和浓缩H2 NanoGAS®水中的氢气浓度分别计算为5.58×10^-4和1.29×10^-2mmol/L。相比之下,基于亨利定律,在标准环境温度和压力下,水中的氢气浓度要低得多,为4.29×10^-7mmol/L。
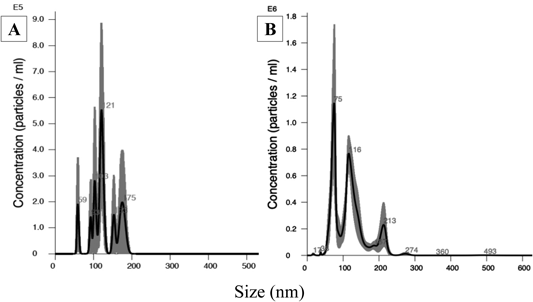
图1. H2 NanoGAS®(HN)和浓缩H2 NanoGAS®(C-HN)水中超细气泡的典型粒径分布
使用旋转蒸发器将HN水浓缩10倍制备的HN水(A)和C-HN水(B)的粒径分布。峰值代表具有相似大小的主导颗粒的浓度,数字表示粒径。线条和阴影表示平均值±标准误差。数据通过使用NanoSight NS300进行纳米颗粒追踪分析。(A)中的数据基于Morishita等人的研究(《生物控制科学》,第27期(2022年))。
天然矿泉水购自SUNTORY Holdings, Ltd.(东京,日本)。浓缩H2 NanoGAS®水储存在4°C,并在使用前30分钟恢复至室温。H2 NanoGAS®水和天然矿泉水储存在室温下。乙醇(80%)购自FUJIFILM Wako Pure Chemical Corporation(大阪,日本),并用自来水稀释得到30%的乙醇溶液。戊巴比妥钠盐购自NACALAI TESQUE, Inc.(京都,日本)。
动物研究
本研究在神户学院大学进行,遵循实验室动物护理和使用伦理委员会的规定(批准号:A21-44)。五周龄雄性Wistar大鼠购自日本SLC, Inc.(静冈,日本)。所有大鼠被饲养在温度为23±1°C、相对湿度为55±5%的房间内,12小时光照/黑暗周期,在整个适应期和研究期间自由获取水和食物。
由于本研究旨在评估H2填充超细气泡对日常饮酒的生理效应,进行了初步实验。大鼠每天一次通过探针口服给予相当于厚生劳动省“适度和负责任饮酒”指标的乙醇溶液(20g/60kg体重=0.3g/kg/d),持续两周。然而,未观察到SOD样活性和MDA水平的变化(数据未显示),随后给予的乙醇剂量为0.6g/kg/d,这是推荐剂量的两倍。这个剂量对应于增加生活方式相关疾病风险的酒精消费量。
根据体重,大鼠被随机分配到四个组之一。天然矿物(NM)水组(n=9)、H2 NanoGAS®(HN)水组(n=9)和浓缩H2 NanoGAS®(C-HN)水组(n=6)的大鼠被提供了水瓶。在实验期间,每天固定时间(上午10:00)口服给予乙醇。在阴性对照组,即自来水(TAP)水组(n=6),口服给予自来水代替乙醇。在每种情况下,大鼠都可以自由摄取测试水,为期两周。
定期测量水和食物的摄入量,收集血样,并在实验的最后一天(第15天)解剖大鼠。在解剖实验中,用腹膜内注射戊巴比妥钠(75mg/kg)麻醉后,将动物固定在热板上的背部位置。确认脚趾失去疼痛反射后,从后腔静脉抽血,导致放血。安乐死后,用100mL生理盐水灌注排空动物的血液,并根据每个实验的协议预处理肝脏样本。通过在4°C下分别以600×g和1000×g离心10分钟,从肝素化或乙二胺四乙酸(EDTA)处理的血液中分离血浆,并储存在-80°C直至进一步分析。
血液生化参数的测量
用于评估生化参数的血浆样本被盲化并外包给Oriental Yeast Co., Ltd.(东京,日本)。总蛋白(TP)、谷草转氨酶(AST)、谷丙转氨酶(ALT)、肌酸激酶(CK)和甘油三酯(TG)的水平在7180临床分析仪(Hitachi High-Tech Corporation, 东京,日本)上使用Total protein-HRII、L-type Wako AST·J2、L-type Wako ALT·J2、L-type Wako LD·J、L-type Wako CK和L-type Wako TG·M(FUJIFILM Wako Pure Chemical Corporation)进行测量。
红细胞(RBCs)和血浆中的SOD样活性使用SOD检测试剂盒WST(Dojindo Laboratories, Kumamoto, 日本)评估,而血浆和肝脏中的MDA浓度使用硫代巴比妥酸反应物质(TBARS)检测试剂盒(Cayman Chemical, MI, U.S.A.)作为抗氧化防御系统的标记物进行测量。
肝线粒体活性的测量
Oroboros Oxygraph-O2k是当前评估线粒体氧消耗的主要仪器,它允许对组织、细胞和线粒体分离物在响应底物、解偶联剂和线粒体呼吸功能抑制剂的滴定下的动态高分辨率呼吸测定进行评估。我们使用Oroboros Oxygraph-O2k(Oroboros Instruments, Innsbruck, Austria)评估了线粒体复合体I(CI)和II(CII)相关的氧化磷酸化能力和CI及CII相关的电子传递链能力作为线粒体氧消耗的功能。
肝脏切片称重后,在含有50µg/mL Digitonin的2mL MiR05缓冲液(Oroboros Instruments)中洗涤两次,每次1分钟,然后在6孔板中用2mL MiR05缓冲液冲洗。洗涤后的肝脏样本转移到100µL的MiR05缓冲液中,匀浆,并用MiR05缓冲液稀释,得到重量为2mg/50µL的肝脏样本。所有操作都在冰上进行。
未能在同一天测量的肝脏样本按照García-Roche等人概述的程序冷冻。22) 称重后,用1mL改良的MiR05缓冲液洗涤样品,并连同改良的Belzer UW®液体(Astellas Pharma Inc., 东京,日本)一起转移到冷冻管中,以获得重量为10mg/1mL的肝脏样本。样本覆盖冰块静置约6分钟,然后在-80°C下用液氮处理20分钟,接着在-196°C下用液氮处理至少10分钟。最后,将样本储存在-80°C直至使用。
测量了肝脏匀浆中氧化磷酸化(Oxphos)和电子传递(ET)系统的氧消耗率(OCRs),并根据之前报告修改剂量和试剂后,获得了线粒体功能指数。23) 通过添加丙酮酸(5mM)、苹果酸(2mM)、谷氨酸(10mM)和ADP(5mM)后测量CI Oxphos;随后在添加细胞色素C(10µM)和琥珀酸(10mM)后测量CI+II Oxphos。通过添加ATP合成酶抑制剂寡霉素(10nM)和去偶联剂碳酰氰间氯苯腙(0.05mM步骤)直到氧消耗达到平台后测量CI+II ET。通过添加鱼藤酮(0.5µM)测量CII ET。最后,添加抗霉素A(2.5µM),并从OCRs中减去更高的残余氧消耗(ROX)。所有试剂均购自Sigma-Aldrich Co., Ltd.(MO, U.S.A.)。使用DatLab 4分析软件(版本7.4.0.4)(Oroboros Instruments)计算OCRs。通过从CI+CII Oxphos中减去CI Oxphos获得CII Oxphos,通过从CI+CII ET中减去CII ET获得CI ET。
统计分析
所有实验均重复三次(n≥3)。对于多重比较,使用ANOVA与Tukey、Games-Howell或Kruskal-Wallis检验。使用IBM SPSS Statistics(版本27)(IBM Corp., Armonk, NY, U.S.A.)进行统计分析。统计显著性设定为p<0.05。
结果
体重变化、总饮水量和食物摄入量的变化
图2A显示了每组的平均体重,图2B显示了每组的平均总食物摄入量,图2C显示了每组的平均总水摄入量。在所有测试组中没有观察到体重减轻,由于饮用水的差异,也没有观察到水或食物摄入量的差异。
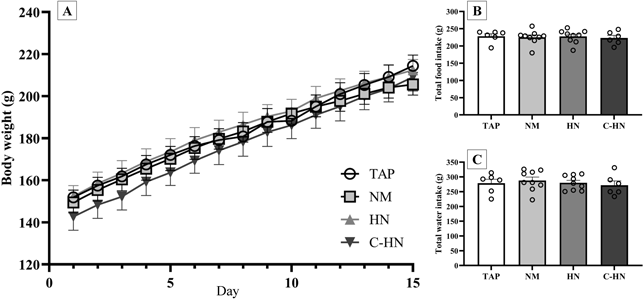
图2. 大鼠口服乙醇两周后对体重、总食物摄入量和总水消耗量的影响
(A) 体重,(B) 总食物摄入量,和 (C) 总水摄入量。每个数据点代表n=6-9的平均值±标准误。
血液生化检测
各组的血液生化检测结果(TP、AST、ALT、CK和TG)如表1所示。TAP组和MW组之间在任何肝功能参数上未检测到显著差异,表明本研究中使用的0.6g/kg/d剂量未引起急性或严重的酒精性肝损伤。尽管AST和CK值呈现出明显的上升趋势,但注意到个体间存在变异。总的来说,这些结果确认了本研究中使用的乙醇剂量效果不显著。
表1. 大鼠口服乙醇2周后(每日一次剂量为0.6g/kg)的血液生化参数
Group | TP (g/dL) | AST (IU/L) | ALT (IU/L) | CK (IU/L) | TG (mg/dL) |
TAP water | 4.6 ±0.1 | 60.7 ± 3.1 | 33.8 ± 2.2 | 335.0 ± 58.1 | 55.7 ± 12.0 |
NM water | 4.6 ± 0.1 | 76.4 ± 17.7 | 31.8 ± 2.3 | 519.0 ± 252.3 | 42.8 ± 4.0 |
HN water | 4.6 ± 0.1 | 92.5 ± 24.4 | 30.4 ± 1.1 | 717.4 ± 342.7 | 57.1 ± 9.9 |
C-HN water | 4.8 ± 0.1 | 100.5 ± 32.3 | 33.5 ± 1.9 | 765.5 ± 386.3 | 54.3 ± 11.9 |
缩写:TP,总蛋白;AST,天门冬氨酸转氨酶;ALT,丙氨酸转氨酶;CK,肌酸激酶;TG,甘油三酯。每个数据点代表n=6-9的平均值±标准误。
血浆和红细胞(氧化应激标志物)的SOD样活性
图3A和B显示了红细胞和血浆的SOD样活性。在NM组观察到红细胞和血浆活性略有下降,而在H2 NanoGAS®组中观察到轻微的恢复,且呈现出浓度依赖性;然而,这种差异并不显著。这表明乙醇诱导的氧化应激对SOD样活性没有影响。
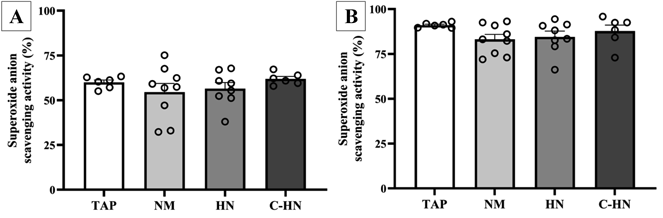
图3. 大鼠口服乙醇两周后红细胞和血浆中的SOD样清除活性
红细胞(A)和血浆(B)中的SOD样清除活性。每个数据点代表n=6-9的平均值±标准误。
血浆和肝脏中的MDA水平
图4A和B显示了血浆和肝脏的TBARS测定结果。MDA是组织样本中脂质过氧化的指标,也是氧化应激的标志物,因为它是脂质过氧化物的降解产物。与阴性对照TAP组相比,NM组的血浆MDA浓度显著更高,这表明连续口服乙醇诱导了氧化应激。C-HN组的MDA浓度显著低于NM组,且后者与TAP组相当。在肝脏中,尽管整体MDA浓度较低且氧化应激的影响不明显,但在NM组观察到比阴性对照TAP组更高的MDA浓度,而在C-HN组观察到较低的MDA浓度(p=0.058)。根据以上结果,填充氢气的UFBs能将口服乙醇摄入升高的脂质过氧化水平维持在正常水平;这种效果取决于UFB的数量(封闭的氢的量)。
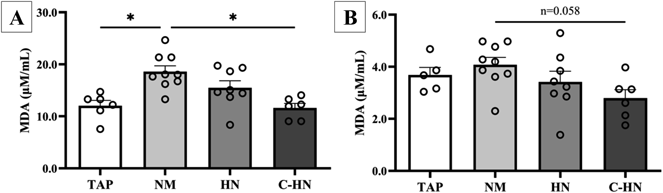
图4. H2 NanoGAS® 将肝脏和血液中的脂质过氧化水平维持在正常水平
大鼠口服乙醇两周后血浆(A)和肝脏(B)中MDA的浓度。每个数据点代表n=6-9的平均值±标准误。*p<0.05。
肝脏中的线粒体活性
肝脏线粒体中ET和Oxphos各自的OCR分别显示在图5A和B中。在所有测量中,ET组(图5A)和NM组的OCR是四组中最低的,这表明氧化应激降低了线粒体的氧消耗,而HN和C-HN组显示出比NM组显著更高的氧消耗水平。特别是对于CI+CII ET,HN组也显著高于阴性对照组TAP组。就Oxphos而言(图5B),总体上,测试组之间没有观察到显著差异或趋势;然而,在NM组中观察到较低的CI OCR,在TAP和HN组中观察到较低的CII OCR,而NM组显示出与CI相当的活动。这些结果表明,饮用填充氢气的UFB水可能已经将氢输送到肝脏,保护肝脏线粒体免受酒精给药引起的氧化应激,从而维持或增强其功能。这些结果还表明,UFB浓度不影响这种效果。
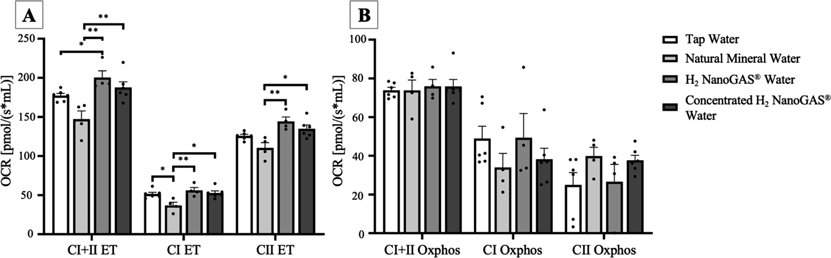
图5. 肝脏线粒体中电子传递链和氧化磷酸化的氧消耗率
在Oroboros Oxygraph-O2k上测量的冷冻肝组织切片中的ET (A) 和Oxphos (B)的OCR。每个数据点代表n=4-5的平均值±标准误。*p<0.05, **p<0.01。缩写:CI,复合体I;CII,复合体II;OXPHOS,氧化磷酸化;ET,电子传递;OCR,氧消耗率。
讨论
氢气因多样生理效应而被认可,许多研究探索了其在水(氢被溶解在水中)中的生物学应用。然而,传统氢水的一个缺点是确保氢气的稳定性,因为氢气是溶解在水中直至饱和。然而,使用除氢水外的其他方法有效利用体内氢气仍然困难。如果通过饮用含有UFB的水能够有效利用气体,那么UFB可以用作输送载体,促进气体向生物体的运输。为了证实这一概念,我们专注于研究H2填充的UFB对酒精诱导的肝脏氧化应激的缓解效果。酒精产生ROS,及其代谢物乙醛的毒性。线粒体是含有乙醛脱氢酶2的细胞器,这是参与乙醛代谢的最重要酶。然而,由于酒精代谢引起的ROS水平升高、乙醛毒性和由此代谢引起的缺氧,线粒体易受损害。因此,在本研究中,我们直接评估了H2填充的UFB对肝脏线粒体活性的影响。
本研究的结果表明,持续的酒精消费显著提高了血液脂质过氧化水平,确认了氧化应激的诱导(图4)。然而,这种效应并不足以引起血液参数的显著变化(表1)。在对照组(NM)中观察到的血液脂质过氧化水平的显著增加,通过C-HN水的摄入显著减弱,肝脏中也观察到类似趋势。此外,在本研究中,基于肝脏线粒体的氧消耗,详细评估了线粒体CI和CII连接的氧化磷酸化能力和CI和CII连接的电子传递链能力。NM组中的ET上的OCR显著低于H2 NanoGAS®组(HN, C-HN)(图5A)。此外,在CI+II ET组中,NM组与TAP组之间没有显著差异;然而,NM组与NanoGAS®组之间观察到显著差异,HN组显示出比TAP组显著更高的氧消耗。这表明尽管线粒体的电子传递系统功能受到乙醇摄入的影响,但这通过H2 NanoGAS®水的摄入维持在正常水平和/或得到增强。相反,在反映ATP合成的CI+II Oxphos组中没有观察到显著差异(图5B)。同样,各组之间在肝脏ATP水平的定量测量方面也没有差异(数据未显示)。在许多情况下,用氢处理应激诱导组增强了ATP产生;然而,在本研究中没有观察到这种现象。这表明本研究中氧化应激的诱导(通过两周每天0.6mg/kg的乙醇摄入)并未造成足够强的效果以损害线粒体的ATP产生,即氧化磷酸化过程。这表明摄入H2 NanoGAS®水没有影响。
分子氢通过减少脂质过氧化和缓解线粒体功能障碍来减轻氧化应激诱导的细胞死亡。27) 鉴于氢能够通过细胞膜扩散到细胞核和线粒体中,14) 一旦它到达目标组织,就可以轻松地扩散到组织中并发挥作用。在这种情况下,我们的结果表明,通过摄取H2 NanoGAS®,氢通过口腔途径到达肝脏,可能是通过门静脉,从而有助于减少在肝脏观察到的氧化应激。
迄今为止,尚不清楚封装在UFBs中的分子氢是如何转移到肝脏的。UFBs可以在水中长期稳定存在,并且据报道,纳米级气泡即使在添加表面活性剂的情况下也不会轻易破裂。28) 然而,在酸性条件下,气泡表面被发现失去了其负电荷,28) 因此变得不稳定。因此,可以推测,口服摄入的H2 NanoGAS®大部分被胃酸溶解。溶解了封装氢气的胃肠道液体预计将迁移到小肠,在那里通过消化道黏膜吸收。随后,氢气通过门静脉系统到达肝脏。29) 关于UFBs作为气泡被吸收的可能性不大,因为小肠中的紧密连接尺寸约为0.4Å,而UFBs通常测量约100nm。为了进一步阐明UFBs作为口服载体输送氢气的实用性,需要更详细地研究气泡在胃肠道中的形态变化以及体内摄入氢气的动力学。
结论
尽管具有生理活性的气体的治疗效果已被广泛研究,但它们在预防和治疗疾病的实际使用中仍然不常见。在这项研究中,我们假设通过使用在液体中具有优异气体保持性能的UFBs,可以实现“饮用”气体。为此,我们试图验证使用填充氢气的UFBs(H2 NanoGAS®)作为生理活性气体的口服输送载体的实用性。氢是一种具有强还原能力的气体,由于其对氧化应激的细胞保护作用,具有生物活性效应,可作为治疗和预防性抗氧化剂。在我们的实验中,大鼠被口服给予乙醇以诱导肝脏氧化应激,并评估了连续两周饮用H2 NanoGAS®水对减少氧化应激的效果。连续饮酒被发现显著增加了对照组血液中的脂质过氧化水平,确认了氧化应激的诱导。血液脂质过氧化的增加显著受到饮用高浓度氢水的抑制。此外,对肝脏线粒体活性的测量显示,饮用HN水维持在正常水平并/或增强了受乙醇摄入影响的线粒体电子传递系统的功能活动。这些结果表明,UFBs可以作为通过口服给药将气体输送到组织的载体,从而在体内发挥生理效应。这些结果突出了UFBs封装各种生理活性气体及其在未来医学领域应用的潜力。
https://blog.sciencenet.cn/blog-41174-1437227.html
上一篇:普通超声连续探测脑脊液生化指标的智能水凝胶【金点子】
下一篇:原子尺度洞察冰表面融化的奥秘