博文
父亲饮食信息能通过精子影响孩子的代谢健康《自然》  精选
精选
|
根据一项针对小鼠和人类的研究,父亲的精子记录了他的饮食习惯——这一记录影响了他儿子的新陈代谢。该研究于6月6日发表在《自然》杂志上。
研究发现,给雄性小鼠喂食高脂肪饮食会增加他们精子中某些类型RNA的水平。研究还显示,这种不健康饮食的雄性小鼠的后代出现了代谢问题,如葡萄糖耐受不良,这是糖尿病的一个特征。根据流行病学分析,身体质量指数(BMI)高的人类父亲的儿子也表现出类似的问题。
写入精子的饮食信息
研究表明,母亲可以将其代谢特征传给后代。至于父亲,盐湖城犹他大学医学院的生殖生物学研究员Qi Chen及其团队在2016年展示了,用来自高脂饮食父亲的精子RNA注射的受精鼠卵发育成具有代谢障碍的小鼠。研究表明,父母饮食的连锁反应不是由后代的基因组改变引起的,而是由他们的“表观基因组”——附着在DNA及其相关蛋白质上的化学标签集合引起的。
在《自然》的研究里,雄性小鼠吃了两周的高脂饮食。研究的作者发现,这种饮食导致了精子线粒体中一种RNA的变化——线粒体是细胞内产生能量的结构。受影响的分子,称为转移RNA,是转录DNA为蛋白质过程中的中间产物。
特别是,吃脂肪食物的小鼠的精子比低脂饮食的小鼠的精子有更多的转移RNA短片段。这样的RNA片段可以作为基因组的表观遗传调节器——例如,增加或减少某些线粒体基因的活性。
线粒体应激
结果很有意义:高脂饮食使线粒体受到压力,德国慕尼黑赫尔姆霍兹中心的环境卫生-表观遗传学研究员Raffaele Teperino说。当受到压力时,线粒体会制造更多的RNA以产生更多能量。
线粒体的响应是一种权衡,未参与该研究的Chen说。线粒体活动的增加使精子有足够的能量游向卵子,但额外的线粒体RNA也会从父亲传给孩子,改变了胚胎从其父亲那里获得的信息,损害了其健康。
Teperino的团队不仅观察了细胞,还观察了那些父亲超重的人和那些父亲吃高脂肪食物的小鼠的健康。后者中约30%有代谢障碍,研究人员发现。进一步的实验显示,这些小鼠后代从其父亲那里获得了比低脂饮食小鼠父亲的儿子多得多的线粒体tRNA。作者还分析了3431名人类儿童的数据,并发现受孕时较高的父方BMI与后代较差的代谢健康有关。
部分证据缺失
该研究的一个技术限制是,用于某些实验的测序方法仅能检测完整的RNA分子。因此,研究无法显示碎片RNA是否从父亲传给了胚胎。“我们假设碎片也被传递,但我们无法证明,”Teperino说。
研究中的小鼠父亲只将代谢问题传给了雄性后代——这与他自己2016年的论文一致——这一点特别引起了Chen的兴趣。“这表明X精子和Y精子携带不同的信息,”他说。为什么X和Y精子会这样做是“一个非常好的未来研究方向”,他说。
Chen表示,这项研究意味着,如果你制造精子,“你应该吃得健康。这会影响你的精子携带的信息。这会影响你的后代”。
Father’s diet influences son’s metabolic health through sperm RNA (yyttgd.top)
细胞线粒体中的DNA只来自母亲,并非遗传自父亲。但是,子代线粒体中的DNA能够感应父系饮食和线粒体质量的线粒体RNA会从精子传递到卵子,影响后代的代谢。
线粒体中的DNA(mtDNA)完全由母亲遗传,这归因于包括在受精前消除精子中的mtDNA的机制1。然而,精子携带的各种类型的RNA可以响应环境条件并影响后代的特征(表型),包括它们是否发展出代谢障碍。《自然》杂志上发表的文章中,Tomar等人发现,在小鼠和人类中,精子中的特定线粒体RNA充当父系饮食和线粒体质量的传感器。这可能通过影响胚胎发育来调节后代的代谢。
精子首先在睾丸中发育,然后通过一个长而卷曲的管道——附睾,在那里它们成熟并被储存。作者着手分析睾丸和附睾环境对后代健康的不同贡献。他们通过喂食两组雄性小鼠精心设计的高脂饮食来实现这一目的,这些高脂饮食旨在模拟导致人类肥胖的饮食习惯。在一组中,小鼠在与雌性交配前两周喂食高脂饮食,这意味着它们的附睾精子受到了饮食的影响。这些小鼠的约30%的雄性(但非雌性)后代表现出葡萄糖不耐受和胰岛素抵抗——这些特征与人类的代谢状况如2型糖尿病相关。
在第二组中,雄性被喂食高脂饮食两周,然后允许清空成熟精子,之后喂食正常饮食四周。这意味着,在后代受孕时,只有父亲的睾丸精子受到了高脂饮食的影响。这些动物的后代没有显示出代谢障碍的迹象。这凸显了附睾精子对父亲饮食的敏感性,以及其对后代健康的影响。
为了调查潜在的机制,团队分析了精子中的小非编码RNA(sncRNAs)。这些短RNA转录本,不翻译为蛋白质,对于通过表观遗传手段介导表型的遗传至关重要——即不改变DNA序列。使用一种称为sncRNA-seq的传统高通量测序技术来识别和定量样本中的小RNA分子,作者发现大约四分之一的线粒体sncRNAs在喂食高脂饮食的小鼠中显著上调。在这些线粒体小RNA中,来源于转移RNA(mt-tsRNA)或核糖体RNA(mt-rsRNA)的特别受影响。相比之下,基因组(源自核DNA而非线粒体DNA)的tsRNAs和rsRNAs变化相对较小。重要的是,来自喂食两周高脂饮食后恢复正常饮食四周的小鼠的精子对sncRNAs的变化极小。
Tomar及其同事还研究了来自人类的数据。他们发现精子中mt-tsRNAs的水平(而不是基因组tsRNAs)与父亲的体重指数(BMI)相关,并且父亲的超重与他们孩子的代谢障碍有关。这些数据表明,精子中的线粒体sncRNAs作为分子传感器,响应小鼠和人类的代谢挑战。这可能是因为在成熟的精子中基因组DNA的转录是不活跃的,而mtDNA的转录仍然活跃5。
这些观察结果背后可能是什么?一种合理的假设是,高脂饮食在精子中诱导了线粒体损伤或功能障碍,导致mtDNA转录的增加以补偿,从而使精子细胞能够维持能量和运动性。然而,这也将导致线粒体tRNA、核糖体RNA及其片段(mt-tsRNAs、mt-rsRNAs)的异常积累,破坏“精子RNA编码”,该编码携带对控制后代表型至关重要的遗传信息。换句话说,这种情况将表明在维持线粒体功能与保留精子携带的RNA信息的准确性之间存在权衡。这一想法与之前的报道一致,即人类急性高糖饮食可以同时增加精子的运动性(可能是由于增强的线粒体活动)并提高精子中线粒体sncRNA的表达。
通过遗传手段干扰线粒体功能,反映了高脂饮食的效果。作者发现,当雄性小鼠携带对线粒体功能重要的基因(如Mrpl23和Ndufb8)的突变时,它们的精子中含有高水平的来自mt-tRNA 5′端的mt-tsRNAs(而非3′端),并产生了患有代谢障碍的雄性后代。这一发现支持了mt-tsRNAs的特征作为改变的线粒体质量或功能的“分子读出”的概念。尽管精子不将突变的mtDNA传递给后代,但线粒体功能的改变——可能通过mt-tRNAs或mt-tsRNAs,或两者兼而有之,以及可能通过其他携带信息的分子——可以深刻影响后代的健康。
为了进一步研究精子线粒体RNA与后代健康之间的关系,团队通过体外受精创建了杂交小鼠胚胎,使用来自喂食高脂或低脂饮食的雄性小鼠的精子,以及属于不同遗传系的雌性小鼠的卵细胞。通过这种方式,他们可以通过查看称为单核苷酸多态性的小遗传变异来追踪mt-RNAs的亲本来源,这些变异在亲本之间有所不同。
作者使用RNA测序来分析两细胞阶段杂交胚胎中的细胞RNA转录本(转录组)。一种称为主成分分析的分析方法,可以绘制样本间基因表达差异的图表,揭示了胚胎具有不同的线粒体(而非基因组)转录组谱,这与父亲的饮食有关。大约30%的由喂食高脂饮食的小鼠所孕育的雄性胚胎中,父系mt-tRNAs的水平比来自低脂饮食父亲的胚胎高出约12倍。其余的雄性胚胎和所有雌性胚胎中的父系mt-tRNAs高出约两到三倍。在同一30%的雄性胚胎中观察到显著的转录重编程,特别是在涉及氧化磷酸化的基因中——这是线粒体产生细胞用于能量的主要分子ATP的途径。
令人好奇的是,30%的雄性胚胎中mt-tRNAs水平非常高与30%的雄性后代患有代谢障碍相吻合,因为这暗示了增加的父系mt-tRNAs(可能还有mt-tsRNAs)在胚胎中与后代的代谢结果之间的联系(图1)。
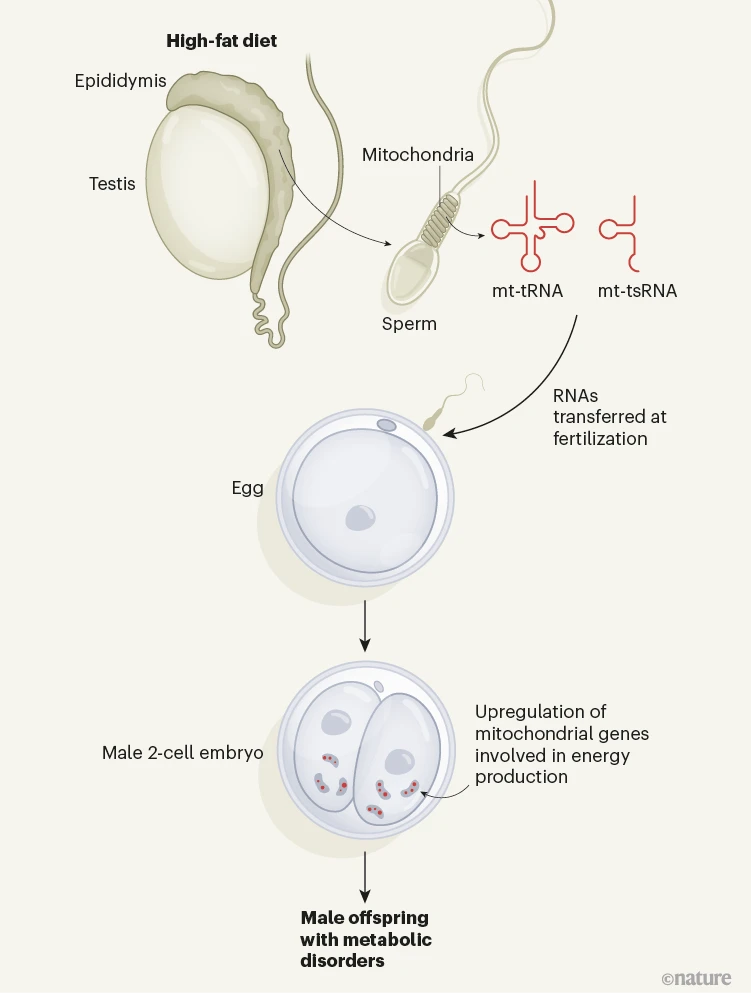
图1 | 精子中的线粒体RNA感应父亲的饮食习惯并影响后代的健康。精子在睾丸中生成,并在一个称为附睾的结构中成熟。Tomar等人发现,喂食雄性小鼠高脂饮食会增加其附睾精子中线粒体小非编码RNA(sncRNA)的水平,这可能是对线粒体功能障碍的响应。在受精期间,线粒体sncRNA(mt-tRNA和mt-tsRNA)被传递到卵细胞中,导致一部分胚胎具有较高的这些sncRNA水平,并且表现出涉及线粒体能量生产的基因上调。类似比例的由喂食高脂饮食的雄性所生的雄性后代显示出代谢障碍,这表明父亲精子中的线粒体RNA谱与儿子的代谢特征之间存在联系。线粒体sncRNA诱导的基因表达变化可能会影响早期胚胎中细胞的分化,影响胎儿与胎盘之间的生长比率。
尽管这项研究取得了进展,但许多问题仍然存在。特别是,精子中的RNA如何影响胚胎发育?有趣的是,氧化磷酸化和线粒体的功能状态会影响细胞分化。因此,改变这些因素之一可能会偏见胚胎命运的决定。这样的决定可能是一个细胞是否分化成为内细胞团(形成胚胎)或滋养外胚层(变成支持性胎盘组织)。这些细胞类型的不平衡可能导致胚胎身体与其胎盘相比发展不成比例,可能导致出生体重过高或过低——这是成人发病代谢障碍的风险因素。
控制精子线粒体中转录的机制,以及生产线粒体sncRNA所需的酶仍待探索。至关重要的是,mt-tsRNA和其他sncRNA含有生化修饰,这些修饰会偏向于从常规sncRNA-seq获得的结果。过去几年开发的一些方法可以绕过这一挑战,并提供更深入了解精子中sncRNA景观的方法。
下一个挑战在于解析精子中的mt-tRNA和mt-tsRNA影响胚胎发育的分子机制。这可能不仅通过sncRNA调节基因表达的典型方式发生——即通过与具有互补核酸序列的RNA或DNA结合——还可能通过它们3D结构的动态变化,以及它们与意外结合伴侣如蛋白质和代谢物分子的功能相互作用。更深入地了解精子RNA编码可以帮助科学家和临床医生做出明智的决策,以预测甚至减轻全球肥胖和糖尿病水平上升背景下后代代谢障碍的风险。
https://blog.sciencenet.cn/blog-41174-1437209.html
上一篇:作者同意撤回2006年《自然》阿尔茨海默病论文
下一篇:普通超声连续探测脑脊液生化指标的智能水凝胶【金点子】