博文
支原体如何入侵到细胞内  精选
精选
|
支原体属于软体属,以其小基因组大小(500-1300 kb)和有限的生物合成能力而著称。它们通过侵入各种细胞类型以作为细胞内病原体存活而表现出致病性。粘附是成功侵袭的关键先决条件,由支原体表面粘附素与宿主细胞膜上的特异性受体之间的相互作用协调而成。侵袭在很大程度上依赖于网格蛋白和小窝介导的内化,伴有多种活化的激酶、细胞骨架重排和无数的形态改变,例如膜内陷、核肥大和聚集、细胞质水肿和空泡化。一旦支原体成功侵入宿主细胞,它们就会在囊泡、细胞质、核周区域和细胞核中建立有弹性的庇护所,其中特定的环境条件有利于长期生存。虽然溶酶体降解和自噬可以消除大多数入侵的支原体,但一些活细菌可以通过胞吐作用释放到细胞外环境中,这是延长感染持续性的关键因素。这篇综述探讨了支原体侵入宿主细胞并使其难以捉摸的生存永久化的复杂机制,旨在强调根除这种神秘细菌的挑战。
Xiu F, Li X, Liu L, Xi Y, Yi X, Li Y, You X. Mycoplasma invasion into host cells: An integrated model of infection strategy. Mol Microbiol. 2024 Apr;121(4):814-830. doi: 10.1111/mmi.15232. Epub 2024 Jan 31. PMID: 38293733.
科学网—支原体感染 - 孙学军的博文 (sciencenet.cn)
科学网—[转载]支原体——隐形且最小的细菌病原体,还会诱发“肺外症状” - 牛耀芳的博文 (sciencenet.cn)
1 前言
支原体是最小的自我复制生物之一。它们具有严格的宿主范围和组织特异性,并且对人类、动物和植物的多种疾病负有责任。例如,在人类中,支原体与急性呼吸道疾病、关节感染以及生殖道和尿道感染有关。动物可能会患上传染性牛胸膜肺炎和传染性山羊胸膜肺炎。相比之下,植物可能受到黄化病、女巫扫把病和柑橘顽固病的影响。尽管支原体感染通常是自限性的,但某些支原体能逃避免疫监视,常在宿主体内建立慢性感染。例如,微小脲原体在泌尿生殖道中可存活长达14天。这些机制包括分子模拟、抗原变异、抗氧化应激抗性、生物膜形成、中性粒细胞陷阱降解、免疫系统调节和细胞内生存。尽管细胞和体液免疫在感染后消除大多数支原体方面具有强大的作用,但在短期内完全根除病原体是一个艰巨的挑战。这一困难主要源于这些臭名昭著的支原体能够侵入包括上皮细胞、内皮细胞、成纤维细胞和免疫细胞在内的各种宿主细胞类型(表1)。这为长期细胞内存活铺平了道路,给临床治疗带来了相当大的挑战。
2被致病性支原体侵入的宿主细胞。
支原体入侵涉及一系列复杂且精细的事件。当遭遇宿主时,支原体通过各种粘附素与细胞外基质或特定的宿主细胞表面受体结合来启动入侵。这种结合触发了一系列事件,包括细胞超微结构的改变、细胞骨架的重排以及各种激酶的激活。随后,支原体通过网格蛋白或小窝蛋白介导的内吞作用进入宿主细胞,并被运输到早期内体。存活的支原体可以被运输到晚期内体。尽管溶酶体或自噬可以将支原体标记为降解目标,但有些能够通过再循环内体进行外排(图1)。在复杂的入侵过程中,支原体获取必需营养素、诱导毒素产生,并通过扰乱信号转导通路和细胞骨架组织,破坏宿主细胞生理功能的微妙平衡。然而,由于生长缓慢以及入侵过程中许多影响因素之间复杂的相互作用,我们对支原体的入侵机制仍存在相当大的认识差距。在本综述中,旨在介绍支原体入侵的复杂过程和独特特点,丰富我们对其与宿主细胞之间错综复杂的相互作用的理解。
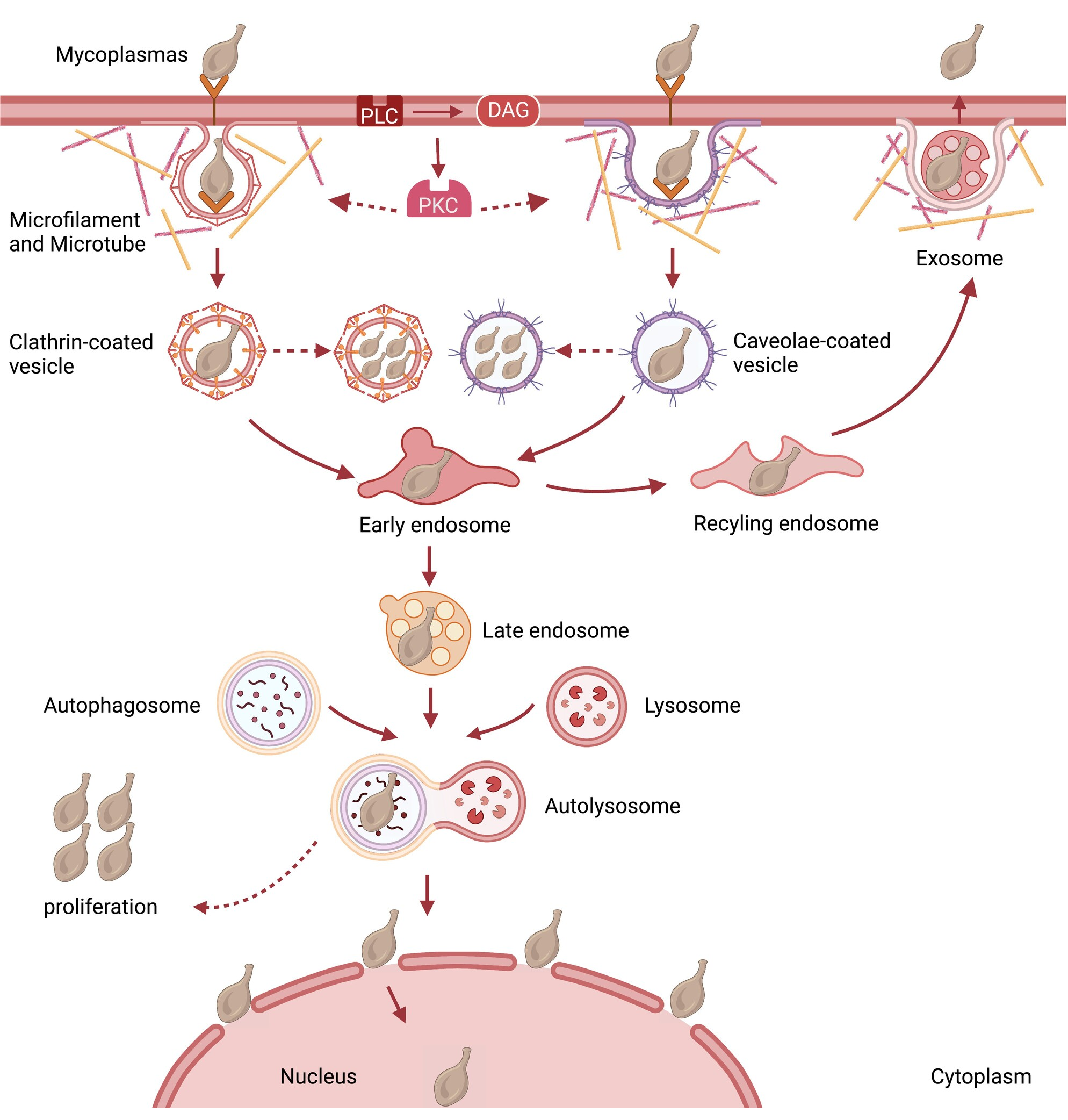
图1:支原体侵入宿主细胞的模型。支原体表面粘附素与宿主细胞受体相互作用,引发由微丝、微管和激酶协同调控的一系列细胞事件。逐渐地,发生膜内陷,形成随后被运输到早期内体的网格蛋白或小窝蛋白包被的囊泡。大多数支原体在膜包围的囊泡内存活,前往晚期内体并与溶酶体融合以实现细胞内生存。然而,一部分支原体屈服于溶酶体降解或自噬,而另一些则被运输到再循环内体,并通过外排作用释放到细胞外环境中。图片改编自Nishiumi等人(2017)MicrobiologyOpen。
表1:被致病性支原体侵入的靶细胞。

致病性支原体侵入宿主真核细胞被认为是颠覆免疫系统和建立慢性持续感染的首要事件。这是因为它们为各种人类和动物支原体创造了生存空间并获取了必需的营养物质。值得注意的是,并非所有支原体都有侵入宿主细胞的倾向,也并非所有任意真核细胞都易受侵染。支原体可侵入包括上皮细胞、内皮细胞、成纤维细胞乃至免疫细胞在内的多种细胞类型(表1)。
人类的支原体包括肺炎支原体(M. pneumoniae)、生殖道支原体(M. genitalium)、人型支原体(M. hominis)、发酵支原体(M. fermentans)、穿透支原体(M. penetrans)和微小脲原体(U. parvum)。这些负责引起呼吸道和泌尿生殖道感染。几乎所有的支原体都能侵入HeLa细胞,即广泛用于研究细胞内细菌培养和病原体毒力机制的永生化宫颈癌上皮细胞系。Hep-2人类喉癌上皮细胞系通常用于研究肺炎支原体、生殖道支原体和穿透支原体的入侵。它与HeLa细胞有许多共同特征,并且易于操作。除了这些常用的细胞系,肺炎支原体还能侵入包括气道上皮细胞、肿瘤衍生细胞和原代正常人类支气管上皮细胞在内的其他多种细胞类型。此外,肺炎支原体能侵入巨噬细胞,而人型支原体通过穿透精子头部和中段区域的胞质空间显示出独特的入侵模式,表明其与生殖系统的复杂关系。值得注意的是,发酵支原体能够成功地逃避免疫反应和抗生素,通过在吞噬体或吞噬溶酶体内生存来保护自己的安全。
动物中的致病性支原体,包括鸡败血支原体(M. gallisepticum)、多样性支原体(U. diversum)、滑液支原体(M. synoviae)、牛支原体(M. bovis)、猪鼻支原体(M. hyorhinis)、山羊支原体(M. agalactiae)、猪支原体(M. suis)和猪肺炎支原体(M. hyopneumoniae),引起家禽、家畜和野生动物的肺炎、乳腺炎、关节炎、耳炎和生殖系统疾病。HeLa细胞也易受M. gallisepticum、M. agalactiae和M. suis等病原体的侵袭。尽管如此,支原体在宿主衍生细胞中表现出更高的入侵效率,正如Matyushkina等人(2016)所示。他们使用HeLa、鸡红血球母细胞系(HD3细胞)和小鼠胚胎干细胞(mES细胞)来分析与宿主细胞的相互作用。他们发现M. gallisepticum在鸡衍生细胞中表现出最高的入侵效率,表明HD3细胞作为M. gallisepticum体内入侵的最接近模型。除了Hep-2细胞,M. synoviae还能侵入鸡红细胞、软骨细胞(CCH细胞)、胚胎细胞系(CEC-32)和滑膜鞘细胞。M. bovis能侵入胚胎小牛鼻甲细胞、胚胎牛气管细胞、肺细胞、炎症细胞、肝细胞和肾小管上皮细胞。此外,M. gallisepticum、M. synoviae、M. bovis和M. suis对红细胞具有明显的趋性,并能在这些细胞内存活较长时间。M. suis的入侵引发严重的溶血,这可能是溶血性贫血发展的关键因素。值得注意的是,同一支原体的入侵效率在不同宿主细胞中有所不同。例如,M. bovis在外周血单核细胞中的数量高于红细胞。
3 参与支原体侵袭的黏附素和受体
细胞粘附代表了支原体表面展示的粘附素与宿主组分之间的一种复杂的相互作用。这是感染和随后的细胞入侵的初始且必要步骤,这一点基于缺乏粘附能力的突变体失去了入侵能力。然而,某些非侵入性的支原体能够粘附到宿主细胞上,这表明细胞粘附是感染的先决条件,最终为入侵的启动做好了准备,尽管它并不必然触发支原体的入侵。因此,粘附和入侵似乎是独立但相互关联的过程,它们协同作用。
3.1 黏附素
粘附素通过两种关键机制介导细胞入侵:细胞外基质(ECM)降解和抗原变异(表2)。M. pneumoniae和M. genitalium的粘附机制已被广泛研究,包括通过末端器官的极性结构进行的细胞粘附和滑行运动。在这些中,M. pneumoniae的P1、P40/P90粘附素和M. genitalium的P140和P110粘附素形成了被称为“Nap”的异源二聚体二聚体。这些粘附素定位到末端器官似乎是启动定植的有效策略。M. pneumoniae通过末端结构的聚集粘附素成功侵入宿主细胞,形成了一个由粘附素和其他与细胞粘附相关的蛋白质如P30、P65和HMW1-HMW3组成的复杂网络。这个网络熟练地绑定到宿主细胞膜上,引发一系列信号转导事件。同时,与末端结构相关的滑行运动通过促进细胞层穿透来增加入侵的可能性(Taylor-Robinson & Jensen, 2011)。此外,M. pneumoniae的表面展示的糖酵解酶,如丙酮酸脱氢酶A-C、甘油醛-3-磷酸脱氢酶、乳酸脱氢酶、磷酸甘油酸互变酶、丙酮酸激酶和转酮酶,与ECM蛋白相互作用,包括纤维蛋白原、纤维连接蛋白、乳铁蛋白、层粘连蛋白和玻连蛋白。这表明,尽管在进化过程中失去了大量对生命活动必需的功能基因,但这些糖解基因的功能多样性无疑在一定程度上补偿了毒力基因数量的不足,从而最大化了它们的致病潜力,包括粘附和入侵活动。粘附素P140和P110与M. genitalium的入侵密切相关;然而,晶体结构显示P140并不直接参与粘附,而是嵌入在P110之间,这表明它在细胞粘附过程中可能起着稳定P110的作用。
TABLE 2. 参与入侵的黏附素.
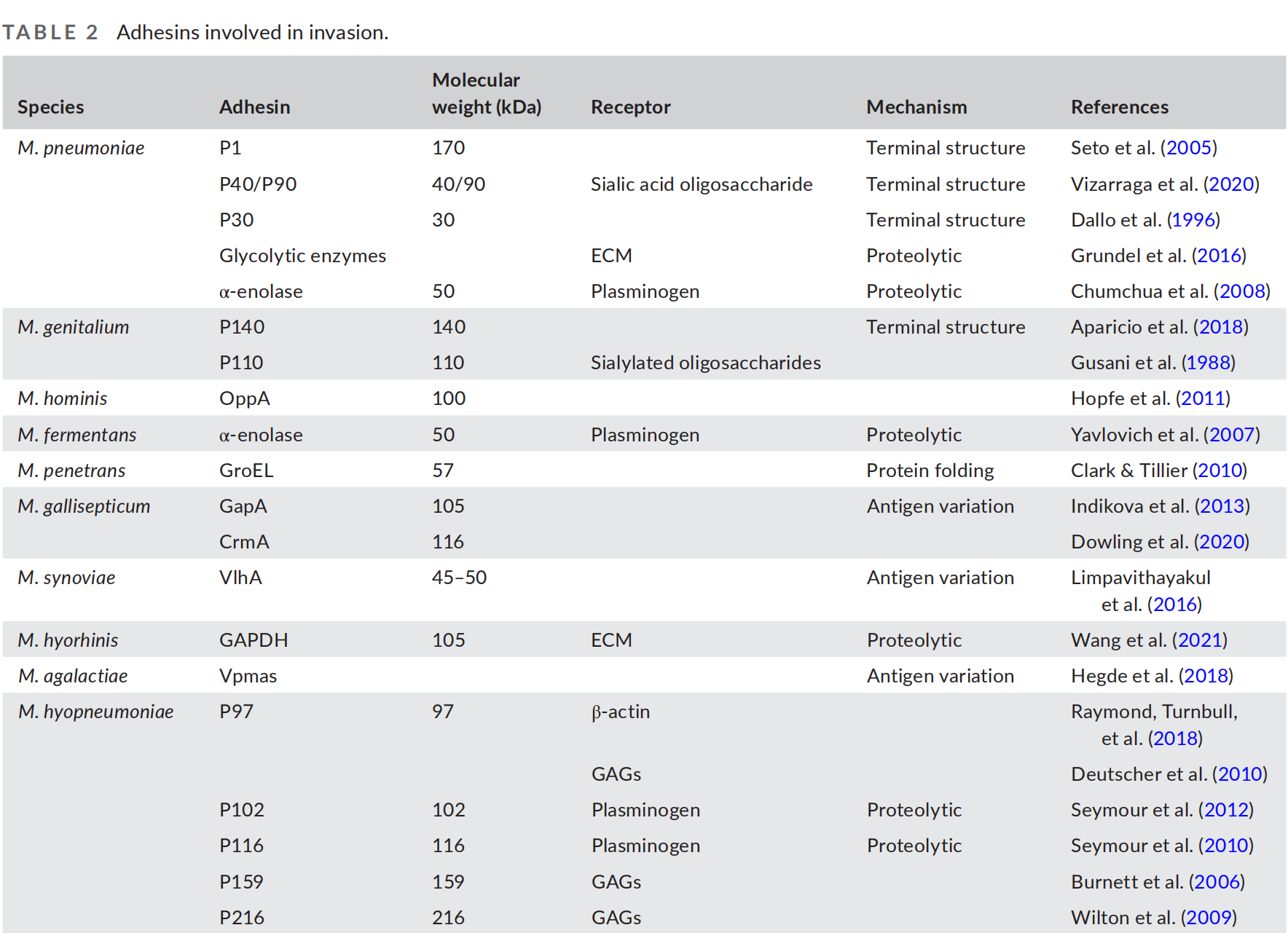
粘附素介导的入侵是动物支原体的一种普遍机制,例如M. hyopneumoniae表达各种粘附素如P97、P159、P216和P271。这些粘附素通过静电力与呼吸道纤毛上的糖胺聚糖(GAGs)的高电荷区域相互作用,描绘出一种在病原体表面结合蛋白和宿主细胞表面之间建立稳定桥梁的有效策略。M. hyopneumoniae招募GAG结合粘附素蛋白以结合各种必需的宿主分子的能力,可能大大有助于M. hyopneumoniae的定植和上皮细胞的入侵。尽管这些粘附素对支原体入侵的确切贡献尚不清楚,但它们在支原体初次粘附到宿主细胞中起着关键作用。然而,支原体入侵涉及多种粘附素的多方面相互作用,凸显了辅助分子在促进细胞粘附和入侵中的重要作用。
OppA是M. hominis中与入侵相关的粘附素,它在粘附中起着关键作用。其功能相关区域的突变会损害粘附活性,从而减少支原体的入侵能力。此外,对M. synoviae分离株的序列分析揭示了N端VlhA蛋白中编码富含脯氨酸重复序列(PRP)的高度多态性区域。具有较长PRP区域的菌株在M. synoviae中表现出更高的入侵性。同样,M. agalactiae展示多种表面脂蛋白(Vpmas)进行活跃的相变化。在六种Vpmas(VpmaU-Z)中,VpmaV是最重要的毒力因子,并显示出最高的粘附和入侵率。这些发现共同强调了某些支原体通过复杂的抗原变异机制的显著适应性,使得粘附素能够通过表型转换响应环境变化而优化。这种现象最终有利于支原体的粘附和入侵,凸显了支原体-宿主相互作用的动态性质。
3.2 受体
我们目前对介导支原体入侵的宿主细胞受体的了解仍然有限;然而,无唾液酸糖蛋白、唾液酸糖共轭物和硫酸化糖脂在介导M. pneumoniae和M. genitalium的附着和进入中的作用已被突出显示。唾液酸是存在于粘膜表面的带负电的亲水碳水化合物,是唾液酸糖蛋白的组成部分。由于它们的分布广泛和必不可少的作用,病原体已经进化出针对宿主唾液酸的粘附、模仿和降解的策略。在M. pneumoniae中,唾液酸作为附着到宿主细胞的受体。值得注意的是,用神经氨酸酶预处理宿主细胞,这种酶可以去除末端唾液酸残基,抑制了M. pneumoniae的附着。同样,唾液酸化的寡糖作为主要宿主受体,在M. genitalium感染期间与P110相互作用。这种相互作用涉及神经氨酸部分与Ser456-Phe457-Ser458三肽的结合,并在细胞粘附中起着至关重要的作用。此外,硫酸化糖共轭物在人类生殖道中丰富,并且是M. genitalium和M. hominis的潜在受体。事实上,薄层色谱覆盖结合测定已确认硫酸糖脂与M. hominis的特异性结合,促进支原体的定植和入侵。此外,唾液酸已被确定为M. synoviae和M. gallisepticum细胞粘附的特定受体。鸡软骨细胞中主要的唾液酸化糖蛋白约为70 kDa,而在CEC-32细胞中约为60 kDa。如前所述,M. hyopneumoniae表面表达的许多粘附素以裂解片段的形式结合到高度硫酸化的GAGs。尽管这种桥接机制在没有形成专用于这些粘附素的特定受体的情况下运作,但它意味着猪呼吸道上皮细胞纤毛表面的GAGs修饰可能作为M. hyopneumoniae表面粘附素的候选受体。
最近,我们对支原体内化的理解已经扩展到包括模式识别受体的参与。在这些受体中,Toll样受体4(TLR4)已经成为M. pneumoniae内化的一个受体,扩展了其在识别革兰阴性细菌中的众所周知的作用。值得注意的是,这种内化是不依赖Toll样受体2(TLR2)的,因为用TLR2缺陷的巨噬细胞感染并没有消除细胞因子的产生。相比之下,TLR4和TLR2双重缺陷的巨噬细胞未能分泌细胞因子,这表明TLR4可能介导M. pneumoniae的入侵或受体内化。值得注意的是,TLR4介导的M. pneumoniae内化可能是先天免疫系统用来消除该生物体的一种机制,而不是M. pneumoniae用来逃避宿主免疫反应的策略。在M. pneumoniae中,TLR4识别的配体似乎是脂质。
主要细胞骨架蛋白肌动蛋白由于其与各种细菌病原体如B组链球菌、M. suis和军团菌肺炎的相互作用而引起了特别的兴趣。在M. suis侵入红细胞后,红细胞内的β-肌动蛋白与M. suis的MSG1相互作用,这意味着β-肌动蛋白可能作为M. suis的潜在受体。Raymond, Madhkoor等人(2018年)使用表面生物素化和3D结构化照明显微镜证明了肌动蛋白在猪上皮单层(PK-15)细胞上的细胞外存在。β-肌动蛋白作为粘附素P97的受体,介导M. hyopneumoniae对PK15细胞的粘附。因此,β-肌动蛋白可能在猪肺内作为M. hyopneumoniae的关键受体,帮助后续的入侵。具体来说,球状β-肌动蛋白作为M. hyopneumoniae的主要受体,结合多个表面暴露的粘附素,而纤维状β-肌动蛋白与M. hyopneumoniae共定位。
值得注意的是,纤溶酶原作为多种表面暴露的粘附素的受体,包括糖酵解酶和分子伴侣GroEL和DNAK,它们作为分子捕捉器与纤溶酶原的细胞表面结合,同时与ECM组分相互作用。一旦结合,表面相关的纤溶酶原在组织纤溶酶原激活剂(tPA)或尿激酶型纤溶酶原激活剂(uPA)的存在下转化为纤溶酶。这种激活引发了伴随ECM降解的蛋白水解级联反应,破坏组织屏障。一些表面糖酵解酶与ECM特定组分或纤溶酶原之间的相互作用被观察到。例如,α-磷酸烯醇式酶可以通过富含赖氨酸的结合动机与纤溶酶原的氨基末端赖氨酸结合位点结合。这种相互作用触发了纤溶酶的产生,从而切割ECM组分。同样,支原体的糖酵解酶,如甘油醛-3-磷酸脱氢酶(GAPDH),可以作为粘附素和纤溶酶原配体,有助于ECM降解,为支原体入侵创造有利条件。
纤连蛋白也作为支原体内化的结合受体。例如,M. hyopneumoniae细胞在感染部位隔离早期表达的纤连蛋白,并与整合素β1相互作用,引起下游信号事件,导致真核细胞骨架重排,促进病原体进入网格蛋白包被的小泡(CCVs)和窖泡。这表明M. hyopneumoniae可能劫持了内在的真核整合素β1-纤连蛋白回收途径以进入宿主细胞,在那里它可以在细胞内持续存在。尽管这是唯一一份关于纤连蛋白和整合素β1之间相互作用调节支原体内化的报道,但在粘附的早期阶段纤连蛋白的结合可能是大多数甚至所有支原体细胞入侵的基础事件,因为纤连蛋白作为许多支原体的受体。尽管支持这一假设的证据有限,但足以鼓励进一步探索。
4.支原体侵入宿主细胞
4.1通过内吞作用穿透宿主细胞
内吞作用是支原体侵入宿主细胞的主要机制。支原体通过顺序转运,从凹陷的膜进入到早期内体,然后通过晚期内体。这种精心协调的进展通过早期内体抗原1(EEA1)和Rab5的存在得到证明,它们作为早期内体阶段的标记物,以及Rab7和LAMP-1,它们指示晚期内体阶段(Nishiumi等,2017年)。例如,U. parvum与回收内体标记物Rab11相互作用,表明支原体能够穿越回收内体,在最终从宿主细胞释放之前。包被有网格蛋白或小窝的囊泡促进U. parvum的摄取,随后与溶酶体融合,或在与自噬标记物LC3相互作用时经历自噬。或者,U. parvum可以通过外泌体释放到细胞外空间。因此,不难想象这些分子有助于U. parvum在生殖道细胞中的传播。同样,M. hyopneumoniae可以通过CCVs和窖泡被内化,这通过EEA1、RAB5、RAB7、RAB11和LAMP1的免疫荧光增强来表明。包被素在介导内吞作用中的参与进一步得到了药理学抑制剂单丹磺酰卡达维和氯丙嗪的支持,这些抑制剂专门针对CCV的形成和内体中包被素的回收,并显著阻断了M. bovis进入初级胚胎牛鼻甲骨(PECT)细胞。此外,内吞作用抑制剂丹磺酰卡达维和小干扰RNA也可以抑制支原体入侵,这表明包被素重链(CLTC)和窖蛋白-1(Cav-1)参与了M. bovis对滑膜细胞的入侵,尽管观察到M. bovis与CLTC之间的共定位比与Cav-1更高。
其他分子,包括膜囊或凹陷、脂筏和TLR4,也涉及支原体入侵。例如,电子显微镜揭示,在M. genitalium侵入HLF细胞期间,膜囊或凹陷的形态特征类似于包被有网格蛋白的坑,这表明这些分子可能执行与包被素类似的功能。Simvastatin是一种降低胆固醇的药物,它抑制了脂筏介导的内吞途径。Chlamydia也使用脂筏介导的途径侵入宿主细胞,这提出了M. bovis可能采用类似内吞途径的可能性。由TLR4介导的内化在支原体入侵中起着关键作用。在与配体结合后,TLR4在质膜上启动信号传导,并形成TLR4/Mal/MyD88复合物,随后通过内体进行内化。Shimizu等人发现,M. pneumoniae感染后诱导促炎细胞因子的产生是通过TLR4介导的内吞作用依赖性过程,这突出了其作为受体在M. pneumoniae入侵和内化以引发炎症反应中的重要作用。
4.2参与入侵活动的信号通路
与专性细胞内寄生体相比,支原体展现出明显较低的入侵效率,这给阐明宿主细胞入侵所涉及的信号通路带来了挑战。例如,估计只有大约8%的M. hyponeumoniae细胞存在于上皮细胞单层中。此外,支原体的入侵效率受多种因素影响,即使在同一种支原体物种内也会导致变异性,影响实验的可重复性。因此,目前对支原体入侵所涉及的信号通路的理解仍然不足,大多数发现仅限于几种物种,如M. fermentans、M. pneumoniae和某些动物支原体。1995年,Andreev等人在HeLa细胞中鉴定出一种145 kDa的磷酸化蛋白,这是在M. penetrans感染后发现的(Andreev等,1995年)。尽管这种磷酸化与入侵之间的确切关系尚不清楚,但酪氨酸磷酸化可能在支原体入侵中发挥关键作用。此外,据推测,M. penetrans与HeLa细胞之间的相互作用导致蛋白激酶C(PKC)的激活,这通过在感染活的M. penetrans细胞后20分钟内,PKC从细胞质转移到质膜的情况得到证实,这表明PKC可能在支原体入侵中发挥关键作用。值得注意的是,在Molt-3淋巴细胞中,观察到在M. penetrans感染后脂质转换的改变,包括二酰甘油和自由脂肪酸(FFA)部分的积累。这些观察可能支持这样的假设:M. penetrans刺激磷脂酶切割膜磷脂,导致触发膜和细胞骨架修饰的信号级联,从而允许支原体入侵。侵袭性支原体,包括U. diversum,具有磷脂酶C(PLC)活性,这与宿主细胞骨架组分重排和信号转导相关。U. diversum中存在磷脂酶活性表明其作为致病因子的潜力,有助于细胞损伤和入侵过程。
4.3 宿主细胞中的细胞骨架重排
一些侵袭性支原体在与宿主细胞相互作用后启动细胞骨架重排,通过肌动蛋白微丝和微管依赖性过程促进它们的内化。这一点通过用微管和微丝破坏药物预处理来证实,显示出在用肌动蛋白聚合抑制剂cytochalasin-D处理后,内化的M. penetrans在HeLa细胞中的数量减少。同样,M. penetrans的内化可以被破坏微管的taxol和vinblastine抑制。这些数据表明,微丝和微管的聚合动态和稳定性对于M. penetrans的入侵至关重要。M. penetrans与Hep-2细胞之间的相互作用诱导细胞骨架变化,通过免疫荧光观察到细胞骨架组分如微管蛋白、α-肌动蛋白和某些磷酸化蛋白的聚集。此外,共聚焦激光显微镜证实,在M. hominis感染HeLa细胞48小时后,肌动蛋白微丝的凝聚和细胞膜上突起的形成,强化了入侵与宿主细胞中肌动蛋白细胞骨架重排相关的观念。然而,有争议的结果表明,微管抑制剂nocodazole降低了M. gallisepticum入侵HeLa-229细胞的频率,而cytochalasin-D没有明显的抑制效果,这表明M. gallisepticum可能在非吞噬性宿主细胞中采用与M. penetrans不同的内化策略。此外,在PK-15细胞中感染M. hyopneumoniae后高表达的肌动蛋白表明,这种侵入性细菌可能在感染期间诱导细胞骨架重排以促进其摄取。
4.4 宿主细胞侵袭后超微粒形态的变化
支原体入侵在宿主细胞中引发了一系列形态学变化,其显著特征是在入侵早期阶段细胞膜的内陷。例如,在M. suis感染的红细胞中,随着入侵的进展,质膜的凹度加深,最终形成囊泡状结构。细胞膜的开口在进入红细胞时融合。同样地,电子显微镜下观察M. bovis入侵PECT细胞时,发现内陷处有直径50纳米的开口,以及细胞内的囊泡和胞质中的M. bovis膜边界。在M. bovis入侵滑膜细胞过程中也观察到了类似的内陷。值得注意的是,M. genitalium可以在HLF细胞的质膜上诱导向内的力,形成杯状凹陷结构,随后产生膜口袋或坑。这些形态学变化表明,真核细胞膜的内陷是一种普遍的超微结构变化,大多数支原体采用内吞途径进行入侵。其他观察到的变化包括牛乳腺上皮细胞在感染M. bovis(ST172或ST173)24小时后细胞收缩、胞质染色深、细胞完整性丧失。此外,M. penetrans的入侵可导致Hep-2细胞单层的破坏和细胞死亡。还有,一部分被M. hominis感染的人类精子表现出弯曲或盘绕的尾部和中段增厚。
5 影响支原体入侵的因素
支原体在入侵宿主细胞的能力上存在差异。粘附是入侵的先决条件,而其侵入性通过粘附素和支原体的滑行运动显著增强。然而,一些支原体的内在因素,如侵入性核酸酶(Mpn133、MG_186和MbovNase),以及外部因素,如培养条件和化学试剂,也在促进支原体进入宿主细胞中发挥作用。抗原变异也增加了某些来自牛和野牛的M. bovis分离株的侵入性,为支原体采用的侵入机制增添了另一层复杂性。
5.1 内在因素
尽管有限的支原体基因组限制了对宿主依赖的代谢前体的获取,但内在核酸酶的存在弥补了这一缺陷。这些核酸酶,包括Mpn133、MG_186和MbovNase,对于核酸前体合成是必需的,并在支原体入侵中扮演关键角色。Mpn133是M. pneumoniae中发现的一种Ca2+依赖性细胞毒性核酸酶,具有一个必不可少的谷氨酸、赖氨酸和丝氨酸富集区域(EKS区域),该区域对于M. pneumoniae内化进入A549细胞至关重要。删除该区域会消除入侵能力,这一点通过EKS标记的mCherry(EKS-mCherry)蛋白的细胞质、围核和核定位得到证明,而不仅仅是mCherry本身。同样地,MG186是Mpn133的同源物,缺乏EKS区域,可能参与M. genitalium的入侵;然而,其确切作用需要进一步研究(Li等,2010年)。在M. bovis中,MBOV_RS02825(MbovNase)既是膜结合又是分泌型核酸酶,具有I型信号序列,其活性依赖于TNASE_3区域。值得注意的是,缺乏TNASE_3区域的突变体显示出酶活性、粘附和内化方面的缺陷。这些结果表明,MbovNase在介导M. bovis进入宿主细胞中起着关键作用。然而,也有可能观察到的支原体突变体入侵能力降低与核酸合成受限有关,而不是直接介导入侵本身。
支原体入侵也受到其他酶类如磷脂酶和纤溶酶的影响,这些酶针对并破坏宿主细胞膜的完整性。在M. hyorhinis中,磷脂酶A(PLA)切割甘油磷脂二酯产生甘油-3-磷酸,导致宿主细胞内形成过氧化氢和细胞毒性。此外,PLA介导的水解释放自由脂肪酸和溶血磷脂,这可能会破坏宿主细胞膜的完整性,促进M. hyorhinis的入侵。此外,几种兽医病原体显示出在其表面招募纤溶酶原的能力,增强其转化为纤溶酶以增加毒力。这种效应在uPA/tPA存在的情况下比单独的纤溶酶原显著增强。例如,在M. hyopneumoniae中,粘附素P102和P116在生理相关浓度下结合纤溶酶原,由tPA激活纤溶酶,导致纤维连接蛋白的降解。体内研究也表明,在感染期间纤溶酶活性增加,支持了M. hyopneumoniae在其定植阶段与纤溶酶原的相互作用。这一过程有助于免疫逃避、降解和穿透宿主组织,从而促进宿主细胞的成功入侵。这些结果突显了磷脂酶和纤溶酶在支原体入侵过程中的重要性。最近,Nunoya等人发现M. bovis感染对支气管上皮细胞有不良影响,包括细胞质水肿和附着部位的细胞骨架网络破坏。这些损伤推测是由氧化剂引起的,并增加了M. bovis穿透宿主细胞的可能性。
抗原变异是支原体入侵的重要内在决定因素。这一显著现象在诸如M. synoviae和M. agalactiae这样的支原体中观察到,它们策略性地切换粘附素的表达,包括VlhA和Vpmas。这有助于粘附和支原体入侵,使它们能在宿主敌对的胞内环境中存活。此外,不同的M. bovis分离株表现出不同的入侵能力,这可能归因于在入侵过程中经历大量抗原变异的可变表面脂蛋白的表达。
粘附素的翻译后加工对支原体入侵至关重要。例如,M. pneumoniae的P1、P40和P90以及M. hyopneumoniae的P159、P102和P216可以在多个位点经历蛋白水解加工。由此产生的切割片段具有与各种宿主分子相互作用的能力。这种蛋白水解过程显示出一定程度的选择性,从而增强了支原体的功能蛋白质组库,并调节表面蛋白的多样性。随着蛋白质切割事件数量的增加,支原体与ECM蛋白结合的能力也随之增加。这有助于提高宿主细胞入侵效率。
5.2外部因素
除了支原体自身所拥有的内在毒力因子外,宿主细胞环境在调节入侵效率方面也扮演了重要角色。温度和感染持续时间是影响支原体感染的普遍因素。与4°C相比,37°C时细胞内的M. penetrans数量显著增加,而细胞空泡化程度在感染4小时后比2小时后更为明显。这些发现与M. penetrans的最佳生长温度相符,表明延长感染时间进一步有助于支原体的内吞作用。营养压力是另一个决定病原体入侵的因素。值得注意的是,即使在最低马血清浓度的条件下,M. penetrans也能表现出显著的生长,而在5%马血清存在的情况下,其入侵能力显著降低,这意味着低马血清水平可以诱导脂质谱的变化,影响M. penetrans的侵入性。此外,M. gallisepticum的低代次群体(Rlow)保留了入侵非吞噬性真核细胞的能力,而高代次群体(Rhigh)则失去了这种能力,同时保持了粘附能力。这些发现表明,M. gallisepticum的繁殖代次可能会影响其入侵潜力,尽管在这些菌株多次传代后可能发生的突变的潜在影响也不容忽视。此外,化学试剂处理可以提高支原体的入侵能力。例如,聚乙二醇800可以改变细胞膜表面水的结构,促进M. penetrans的结合和Molt-3淋巴细胞的入侵。相比之下,氧化剂如过氧化氢和超氧物可以破坏细胞质并扰乱细胞骨架网络,可能为M. bovis创造进入位点。值得注意的是,用蛋白酶K预处理显著增强了M. hyorhinis粘附和入侵黑色素瘤细胞的能力,可能是通过激活或暴露支原体表面粘附素。因此,临床上使用影响细胞膜通透性的药物来治疗某些感染性疾病可能会增加继发性支原体感染的风险。
6 细胞内生存的意义
6.1 支原体的细胞内生存
进入宿主细胞后,支原体主要定位于细胞质和核周区域。例如,M. pneumoniae存在于各种细胞类型的细胞质和核周区域,如Hep-G2、N2-A和A549细胞。同样,M. genitalium表现出明显的核周和核靶向倾向,并在HeLa和EM42细胞中持续存在较长时间。此外,U. diversum、M. synoviae和M. canis广泛分布在这些区域,而M. hyorhinis侵入黑色素瘤细胞,大部分内化的支原体随机分散在靠近细胞膜的细胞质中。
某些支原体在增殖过程中居住在膜包围的囊泡内,电子显微镜观察已证实了这一点。例如,M. genitalium在Vero细胞内繁殖,后代支原体居住在囊泡中。M. genitalium的入侵似乎是动态的,因为随着感染时间的延长,细胞内支原体的数量显著增加,并至少保持48小时的高水平。相反,与M. genitalium相比,M. penetrans对Hep-2细胞的入侵速度相对较快,内化的生物体要么自由存在于细胞质中,要么封闭在囊泡内。对于HeLa细胞,即使在感染24小时后,M. penetrans也可以居住在内质网中。M. bovis在PECTs中形成簇状物,没有特定定位到特定的细胞室,并且在78小时的感染期内可以在细胞内增殖,导致病原体广泛传播。然而,M. gallisepticum并不总是随着感染进展而增殖。由于自我消化或从宿主细胞释放,内化的支原体数量可能会减少。尽管如此,在感染期间存在庆大霉素时,内化的病原体数量仍然增加,这表明M. gallisepticum可能具有进行细胞内复制的能力。
支原体在宿主细胞内长期存活的确切机制仍然不清楚。近期研究强调了有助于细胞内存活的因素。特别有趣的是,在宿主细胞中发现了甲基化依赖性沉默机制,这导致入侵的支原体CG甲基化水平降低。高度CG甲基化的M. hyorhinis表现出受损的繁殖能力,而较低的CG甲基化水平有利于支原体在被感染的宿主细胞内存活。在M. gallisepticum中上调SpxA表达可能有助于其延长细胞内的存活时间,因为在Bacillus subtilis中SpxA表达赋予了对各种压力因素的防御能力。因此,可以合理假设M. gallisepticum中SpxA的上调在其适应细胞内环境过程中发挥了关键作用。此外,MG_186已被确定为M. genitalium细胞内存活的一个必要因素,因为它在宿主中调节核酸降解以促进支原体生物合成功能和复制。
另一个发人深省的事件是支原体能够忍受长期的细胞内存活,并通过外排作用释放到细胞外环境中,从而逃避内体降解和自噬。这种策略允许细菌在细胞外环境中以活性状态繁殖,从而主动侵入各种宿主细胞并促进它们的系统传播。
6.2 细胞入侵的意义
当入侵到宿主细胞后,支原体对宿主细胞的生存和生理功能产生了深远的影响。值得注意的是,宿主细胞为支原体的增殖提供了一个特权生态位,使得这些臭名昭著的病原体对抗生素或免疫介导的杀伤具有显著的抵抗力。尽管在感染期间存在不完全的免疫反应,这种抵抗力仍然存在。另一方面,某些细胞毒性产物,如核酸酶,可以在宿主细胞内引起DNA损伤,因为支原体在细胞内持续存在。在支原体与宿主细胞之间的相互作用过程中,出现了各种细胞生物学行为的变化,例如抑制凋亡和抗肿瘤事件,共同促成了与支原体相关疾病的复杂发病机制。
尽管支原体很早就被先天免疫系统识别,触发了吞噬细胞的吞噬过程或TLR4介导的内部化以促进促炎细胞因子的分泌,但宿主细胞的快速入侵对清除细胞内支原体构成了巨大障碍。即使在建立有效的免疫反应时,这一挑战仍然存在,尽管免疫系统有能力减少细菌负担。支原体穿过粘膜屏障并建立抵抗免疫反应和抗生素干预的理想生态位的能力进一步增加了完全根除的艰巨任务。此外,入侵的支原体在宿主细胞内经历抗原变异,加剧了抗感染免疫力消除这种逃避性病原体的挑战。
尽管不同宿主细胞的支原体入侵带来各种风险,一些支原体通过分泌有毒酶或代谢产物表现出真正的致病性,这些产物在宿主细胞内引起DNA或氧化应激损伤。值得注意的是,分泌性核酸酶如MG-186、Mpn133和MbovNase的活性与核DNA降解有关,而甘油代谢异常导致有害过氧化物种在细胞内积累。
入侵后,支原体通过扰乱宿主细胞的增殖动态引入了重大风险。值得注意的是,U. diversum感染对细胞生长具有双重影响,早期促凋亡事件过渡到晚期抗凋亡事件。这些复杂的事件可能部分通过调节NF-κB活性介导,为支原体在宿主细胞避难所内的生存、复制和传播提供了有利环境。宿主细胞增殖信号的改变似乎是支原体致病性的不可或缺的组成部分。从机制上讲,支原体中的分子伴侣蛋白在这些事件中扮演重要角色。例如,一些支原体表达DnaK,抑制DNA修复机制并抑制p53的转录活性。这表明它们可能具有潜在的致癌特性。此外,支原体与宿主细胞之间的长期慢性相互作用可能导致细胞行为的不可逆变化。值得注意的是,M. fermentas、M. hominis和M. genitalium已在肿瘤微环境中被检测到,尽管需要进一步研究以确定支原体在这一背景下的确切致癌活性。
7 未来展望
尽管自1980年代以来就有关于支原体细胞内生存的证据,但由于支原体对营养的严格要求和缺乏先进的基因编辑工具,我们对支原体入侵的复杂机制的理解仍然受到严重限制。粘附是入侵的不可或缺的先决条件。然而,确定哪些特定类型的粘附有助于成功入侵仍然是一个挑战。此外,即使在使用相同类型和相同粘附功能的支原体感染以及实验条件下,也观察到细胞入侵效率的显著差异。这引发了一个基本问题,为什么只有一小部分支原体能成功入侵宿主细胞,而大多数则失败,这表明既有支原体也有宿主细胞的参与。探索支原体内在的毒力因子和涉及宿主细胞膜入侵的受体是未来研究的关键途径。然而,由于支原体基因组的精简特点,识别这些毒力因子提出了巨大挑战,使得基因编辑变得异常艰难。尽管最近出现的“超稀有重组事件选择”编辑技术在推进支原体功能基因研究方面充满希望,但有可能随机插入到目标位点的功能性酶(GP35和Cre)可能不会完全沉默基因的功能。此外,重组体在多次传代后是否保持稳定也存在争议。因此,要全面了解控制支原体入侵的复杂机制,仍有大量工作要做。
破译涉及支原体入侵的复杂信号通路是一项重大的科学努力。值得注意的是,尽管内吞作用高度依赖于网格蛋白和窖蛋白,脂筏、微管、微丝以及通过甘油代谢产生的H2O2也可能有助于支原体入侵。然而,关键分子或激酶的确切身份仍然不明。固有的不稳定性或可重复性差,加上低效率和漫长的支原体入侵周期,为破译入侵背后的复杂信号通路构成了巨大障碍。此外,支原体在入侵后如何返回到细胞外空间的机制仍然不清楚。迄今为止,研究主要集中在描述和表征该生物体,因为支原体的缓慢生长和有限的合成能力为系统研究带来了实质性挑战。
支原体入侵的生理意义被广泛认为是逃避宿主免疫应答的策略。在宿主细胞内建立避难所,支原体建立了一个自然庇护所,保护它们免受免疫清除,使得传统抗生素治疗变得困难。此外,这种入侵在慢性感染中发挥关键作用,特别是在泌尿生殖道内。然而,问题仍然存在,即为什么细胞内的支原体难以被细胞内模式识别受体识别,阻碍了有效免疫应答的启动,这是在其他细胞内寄生虫中观察到的现象。转录组分析有希望揭示有见地的线索;然而,建立一个准确模拟简单细胞内支原体感染的强大细胞模型代表了另一个相当大的挑战。总之,探索支原体与真核宿主细胞在细菌入侵、细胞内生存和广泛传播的各个阶段的相互作用揭示了知识的关键点。在这个领域内,阐明控制支原体渗透入宿主细胞的神秘机制,指导其后续路径。通过应用功能基因组学,包括精确的遗传操作关键基因或在目标宿主细胞中控制关键基因的表达,识别有希望的治疗靶标和疫苗候选者变得越来越可行。因此,这为开发有效的替代和/或辅助治疗方法和预防策略开辟了途径。
https://blog.sciencenet.cn/blog-41174-1431606.html
上一篇:食物元素周期表计划
下一篇:不同来源氢分子自由基清除活性比较【22章】