博文
代谢起搏器确保淋巴细胞活化竞赛的顺利进行  精选
精选
|
代谢起搏器确保淋巴细胞活化竞赛的顺利进行
淋巴细胞是高度动态的细胞,在遇到抗原时会发生快速的表型变化。在没有同源抗原的情况下,淋巴细胞在血液和淋巴组织中以小的静止细胞的形式再循环。外部刺激,如细胞因子和非常弱的抗原受体结合,诱导葡萄糖和其他必需营养素的低水平消耗,以维持细胞稳态。结合同源抗原后,从抗原和共刺激受体转导的信号会驱动细胞转录组、蛋白质组和代谢组发生剧烈变化,以支持淋巴细胞增殖、分化和功能。细胞周期进入的速率以及增殖程度在应答细胞之间是异质的,但可以通过抗原受体对其配体的亲和力进行调节。虽然目前大多数知识都集中在信号转导途径上,这些途径导致效应蛋白增殖和合成所需的基因表达,但对淋巴细胞激活过程中刺激强度与代谢组之间的关系知之甚少。
在本期《科学免疫学》中,Turner 等人。(1)研究抗原受体刺激的强度如何在早期淋巴细胞活化过程中调节代谢活性,并确定NAD(烟酰胺腺嘌呤二核苷酸)是控制静止退出的关键限速代谢物(图1)。他们专注于 CD8 T 细胞,其激活是由 T 细胞受体 (TCR) 对呈递抗原的识别启动的。在T细胞反应的早期阶段,具有多种抗原亲和力的抗原结合克隆被激活并增殖。然而,这种早期反应的动态因 TCR 刺激的强度而异;具有更强抗原亲和力的 T 细胞表现出更高的转录激活率和细胞周期进入率,并且它们积累的数量更多 (2–4)。我们对这种基于亲和力的调优背后的机制的理解仍然不完整。
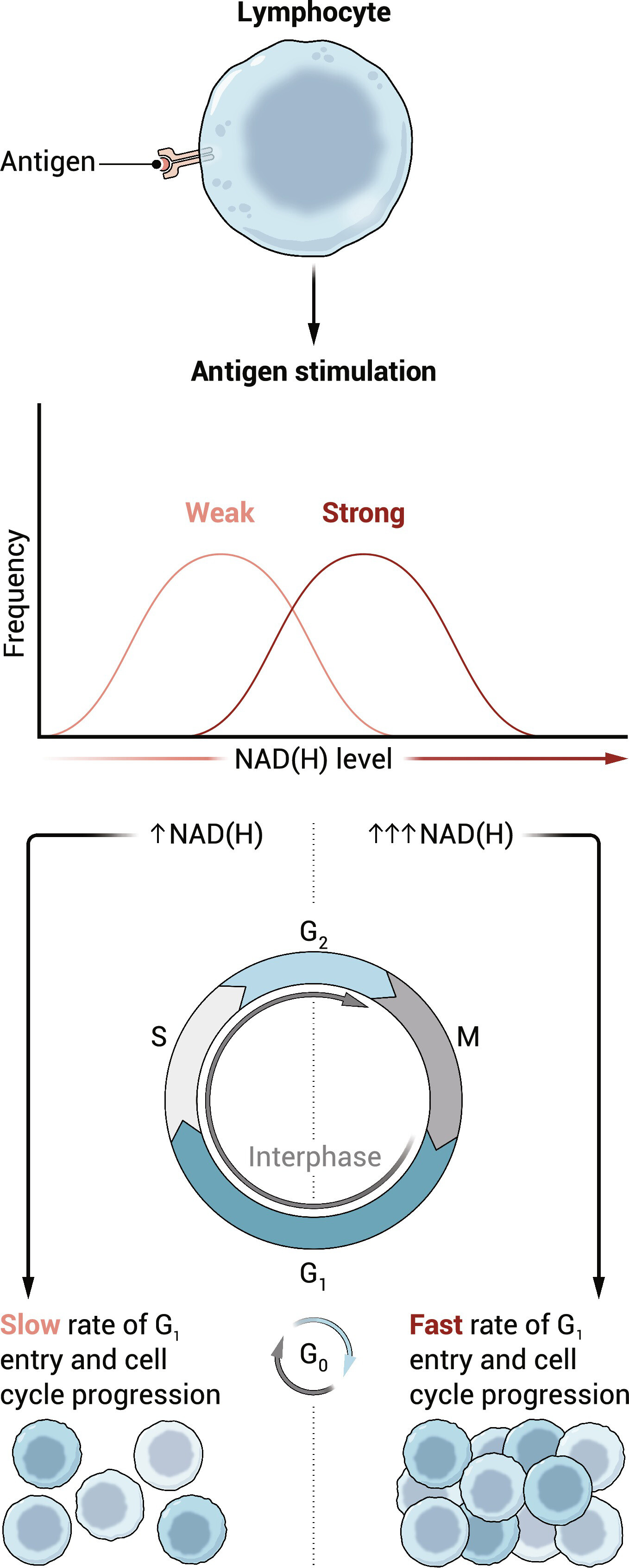
图 1.响应抗原刺激的NAD的生物合成控制淋巴细胞增殖。
遇到抗原后,淋巴细胞会增加NAD的产生。NAD(H)的积累在细胞之间是异质的,其群体水平由刺激强度调节。产生的NAD(H)量决定了新激活的淋巴细胞退出静止的速率及其增殖的程度。
先前 MYC、mTOR 和 IRF4 的亲和力相关活性证据表明细胞代谢和激励 Turner 等人参与其中。研究由不同强度的TCR刺激引起的代谢物丰度的变化。他们使用液相色谱-质谱法来鉴定由不同亲和力肽刺激的 OT-I TCR 转基因 T 细胞中的亲和敏感代谢物。从聚类和通路分析来看,NAD 成为一种推定的枢纽代谢物,其积累与刺激后 24 小时(即第一次细胞分裂之前)的亲和力密切相关。这一发现使用替代 NAD 测量得到验证,并在用不同浓度的抗 CD3 抗体刺激的多克隆 T 细胞中得到证实,其中代谢物的氧化 (NAD[]) 和还原 (NADH) 形式的浓度与刺激强度相关。虽然以前已知NAD水平会随着T细胞刺激而增加[参见,例如(5)],但这提供了刺激强度依赖性效应的第一个证据。+
为了了解抗原亲和力如何控制NAD(H)水平,作者考虑了T细胞活化是否增加了NAD的合成,减少了消耗,还是两者兼而有之(1)。使用靶向质谱法区分NAD产生的三种途径,他们发现只有NAD挽救途径代谢物以刺激强度依赖性方式积累。此外,FK866 通过烟酰胺磷酸核糖基转移酶 (NAMPT) 抑制 NAD 挽救通路 (5) 处理可防止激活诱导的 NAD 积累;这只能通过补充烟酰胺核苷 (NR) 来挽救,这是一种不依赖 NAMPT 的 NAD 前体。同时,NAD消耗率保持不变,表明NAD挽救途径是刺激依赖性NAD积累的原因。
Turner等人测试NAD(H)积累是因果介质还是仅仅是亲和力依赖性增殖反应的相关性。结果显示,用 FK866 抑制 NAMPT 可阻断静止退出。通过抑制NAMPT和滴定NR来控制NAD合成,他们证明限制强刺激细胞中的NAD合成可以模拟弱刺激细胞的细胞周期曲线。这些数据表明NAD(H)积累在调节CD8 T细胞静止退出中的因果作用,作者进一步证明这种机制也延伸到CD4 T和B淋巴细胞。有趣的是,在CD8 T细胞中定时施用FK866表明,对NAD的需求仅限于细胞周期进入前的阶段。这一发现表明,代谢程序的确定至少部分早于先前关于不对称分裂导致代谢相关因子(包括 MYC、mTORC1 和 PI3K)不均等遗传的报道 (6–8)。结合最近的证据表明,不对称分裂在强刺激细胞和弱刺激细胞中具有不同的影响 (9),这些数据表明可能存在多个控制 T 细胞增殖的代谢检查点。+++
通过利用NADH的自发荧光特性来评估其在单个细胞中的积累,Turner等人。能够在刺激后对具有不同水平NADH的细胞进行分选,并发现糖酵解和呼吸速率以及随后的增殖存在很大差异。此外,使用这种分选策略使强刺激和弱刺激细胞中的NADH水平正常化,减轻了增殖中与亲和力相关的差异。这些结果突出了 T 细胞活化的概率性质,并让人想起 T 细胞活化其他阶段的发现,其中一部分弱刺激细胞的行为与接受强刺激的细胞相似 (4, 10)。
Turner等人。还研究了不同水平的 NAD(H) 积累如何影响体内 T 细胞反应。NAMPT 在多克隆 CD8 T 细胞中的过表达导致总体亲和力降低,但不导致对感染反应的程度降低,这表明增加 NAD(H) 的基础水平允许低抗原亲和力的 T 细胞更大扩增。根据 NADH 丰度对 T 细胞进行分选并额外培养 3 天以检查早期效应功能的获得,结果显示 NADH+高细胞产生比NADH更多的INF-γ和TNF-α低细胞。为了继续这一研究,作者收养了分类的NADH高和 NADH低OT-I T 细胞进入感染了单核细胞增生李斯特菌菌株的宿主,该菌株表达了 OT-I T 细胞的同源肽配体。有趣的是,虽然两个种群的扩张在感染后第 7 天保持相等,但 NADH低细胞在感染后 35 天持续存在。这种差异持久性进入响应记忆阶段的机制尚不清楚。更一般地说,需要更多的研究来描述NAD(H)水平与亚群分化命运之间的关系。然而,从提供的数据来看,很明显,NAD(H)的积累对免疫反应的进展和消退具有持久的影响。
一个主要的悬而未决的问题是NAD(H)代谢中枢如何由其他TCR诱导的信号通路驱动并与之相互作用。Turner等人。发现NAD水平不仅反映了TCR连接,还反映了来自共刺激受体和IL-2的同时发出的信号,表明该代谢物整合了多种信号通路。他们观察到亲和力和共刺激对 Nampt mRNA 表达的类似影响,这表明信号整合发生在该酶转录的上游。在 TCR 刺激期间用 FK866 抑制 NAMPT 和仅在去除 TCR 刺激后使用 NAD 前体 NR 进行拯救的实验表明,持续的 TCR 信号传导不是 NAD 许可细胞退出静止的必要条件。这一发现表明,在TCR刺激后,使细胞周期进入的机制的激活持续存在,并与NAD积累同时发生。同样使用FK866介导的抑制,作者发现mTORC1活性,MYC表达和许多代谢物(特别是GAPDH)的丰度是NAD的下游。总之,这些数据提供了对早期T细胞活化过程中转录组、蛋白质组和代谢组之间复杂相互作用的一瞥,并可以作为未来研究的起点。
Turner等人的发现。(1)提出了一种新的模型,说明抗原受体和共刺激信号如何转化为单个代谢物的积累,以满足活化淋巴细胞的能量需求。该研究还提出了一些重要问题:TCR和共刺激信号如何转化为代谢重编程?NAD(H)水平如何影响活化淋巴细胞的后续分化命运?这项研究的结果能否用于开发更有效的疫苗?最后,这项工作强调了在寻找细胞反应中的调控中心时不仅要考虑转录组和磷酸化蛋白质组,还要考虑代谢组的重要性。
https://blog.sciencenet.cn/blog-41174-1426985.html
上一篇:烧伤患者高压氧治疗的问题
下一篇:AI如何帮助天气预报