博文
铁介孔碳纳米颗粒实现氢光热协同治疗
|
我们开发了一种新方法,用于合成嵌入介孔碳纳米颗粒(C/Fe-PEG NP)中的聚乙二醇改性超小铁,用于氢(H2)辅助光热协同治疗。本文采用简单的原位还原方法,一步碳化得到C/Fe NP,通过C/Fe NP表面的生物相容性聚乙二醇(PEG)进一步改性,在生理溶液中获得高稳定性。利用在弱酸性肿瘤微环境中介孔碳和可控 H2 的释放特性、优异光热性能C/Fe-PEG NPs和超小Fe,可有效杀灭癌细胞,同时保护正常细胞,无需药物。C/Fe-PEG NPs的这种选择性抗癌机制可能是因为H2能选择性改变线粒体能量代谢。体内结果证明,C/Fe-PEG NPs具有优异的肿瘤消融治疗效果,正常组织保护能力获益于H2-辅助光热Therpay,有望在未来的癌症治疗中使用具有更多安全性的新型纳米材料。
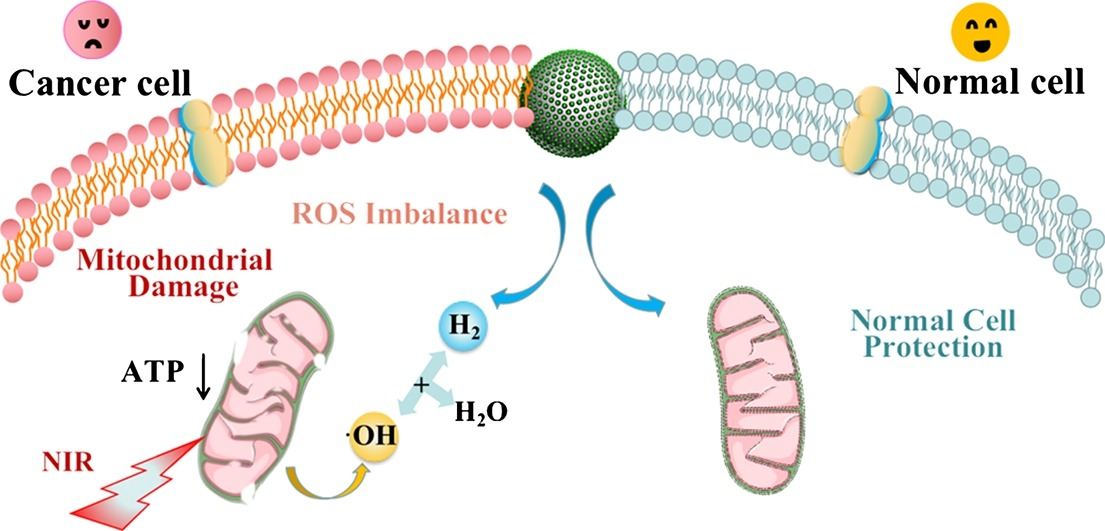
气体疗法是一种新的治疗方法,主要用于替代传统的治疗药物,如硫化氢、 一氧化氮、一氧化碳 和二氧化硫。尽管气体疗法取得了巨大进展,但大多数气体分子都是有毒的,可能对正常组织造成强烈毒性的风险。在各种气体中,一种本质上更安全的气体,氢气(H2)具有广泛生物反应性,可治疗多种疾病。氢疗法的机制是利用具有生物还原特性的氢分子与在肿瘤部位高度表达的活性氧(ROS)、羟基自由基(⋅OH)发生反应,导致ROS水平降低,破坏肿瘤环境的动态平衡,导致氧化应激,最终导致肿瘤细胞坏死或凋亡。然而,H2溶解度相对较低,通过常规给药途径(包括吸入H2)具有很强的扩散能力,口服摄入H2-富水和注射富H2盐水。同时,当遭受ROS的变化时,细胞可以进化出多种生存机制来适应这种刺激,重新建立细胞稳态的平衡并减少损伤,称为细胞应激反应(CSR),这可能会大大降低癌症的治疗效果。因此,迫切需要开发不仅具有特定部位高H2释放的材料,还可以结合其他新颖的治疗方法来获得更有效的癌症治疗。
研究人员开发了各种材料来装载或生产H2并利用肿瘤微环境(TME)的独特性质,如温和的酸度、高渗透性和过高的ROS等,实现了位点特异性H2目标交付和释放。H2生成用于治疗重大疾病的纳米材料前景广阔,为了达到更好的氢疗效果,设计出尺寸更小的材料可以产生更快、更多的H2满足立即杀死癌细胞的需要,防止CSR。此外,作为一种无药物纳米药物,该材料还可以结合光热疗法(PTT),使用光热剂以非侵入性方式将光能转化为热能,以更强烈、更有效地杀死肿瘤细胞。在各种光热转化剂(PCA)中,碳相关材料具有优异的PTT性能和吸附能力,不仅可以是PCA,而且可以很容易地与其他材料结合,实现协同肿瘤治疗。
为了应对这些挑战,我们合成了一种嵌入铁的聚乙二醇(PEG)改性介孔碳纳米颗粒,称为C/Fe-PEG NPs,作为一种无药物的协同治疗纳米平台,可以产生更多的H2。由于颗粒超小,在特定肿瘤部位具有更快的生产效率,同时具有理想的光热转换能力,更好用于氢疗和PTT的联合治疗,如方案1所示。我们证明了C/Fe NPs可以在温和的酸性条件下产生H2,并有效清除羟基自由基。在细胞水平上,我们详细讨论了H2对癌细胞进行选择性治疗但保护正常细胞的机制。最后,我们证明了C/Fe-PEG NPs通过协同氢/光热疗法有效地消除了小鼠的肿瘤。
结果与讨论
C/Fe NPs的合成采用简单的原位还原法进行一步碳化工艺,相应的扫描电子显微镜(SEM)、透射电子显微镜(TEM)图像、各步骤的粒径分布和Zeta电位如图1(A-C)和S1所示。
结论
综上所述,我们开发了一种合成C/Fe NPs的新方法,用于协同氢气和光热疗法。与先前报道的铁相关制氢材料相比,本工作在碳材料上制备了超小Fe纳米颗粒,可以在酸性条件下产生H2,C具有光热转化能力,可以结合在一起进行选择性协同抗癌治疗。
文献信息
通讯作者来自东北师范大学化学系
Wang Z, Zhou X, Chen X, et al. Mesoporous carbon nanoparticles embedded with iron in hydrogen-photothermal synergistic therapy[J]. Journal of Colloid and Interface Science, 2024.
未经本人同意,请不要转发。
https://blog.sciencenet.cn/blog-41174-1421988.html
上一篇:RNA编辑发展加速前进
下一篇:溶剂化电子