博文
自身抗体的健康和疾病价值  精选
精选
|
自身抗体的健康和疾病价值
过去认为自身抗体和自身免疫疾病密切相关,最新观点认为,自身抗体远远不是导致自身疾病那么简单,其实是代表身体健康状况和许多疾病的一个重要特征,甚至是许多疾病发生发展的重要病理生理学机制。那么对自身抗体进行全面描述的自身抗体组学就显得非常有意义了。
人体的生长、发育和生存有完整的自身免疫耐受机制的维持,正常的免疫反应有保护性防御作用,即对自身组织、成分不发生反应。—旦自身耐受的完整性遭到破坏,则机体视自身组织、成分为“异物”,而发生自身免疫反应,产生自身抗体。正常人体血液中可以有低滴度的自身抗体,但不会发生疾病,但如果自身抗体的滴度超过某—水平,就可能对身体产生损伤,诱发疾病。自身免疫性疾病中有许多自身抗体,其中最重要的是抗核抗体。
调查健康结果个体差异的原因导致了对人类生物学的变革性见解,以及几乎每个医学分支的进步。从历史上看,人们一直强调遗传因素如何促进种群内的表型变异。然而,一个新兴的概念是,自我反应性抗体(自身抗体)代表了影响人类健康和疾病的关键但在很大程度上未被充分探索的因素。研究自身抗体及其在疾病中的保护和病理作用可能会解锁新的治疗范式,就像之前对遗传学的研究一样。
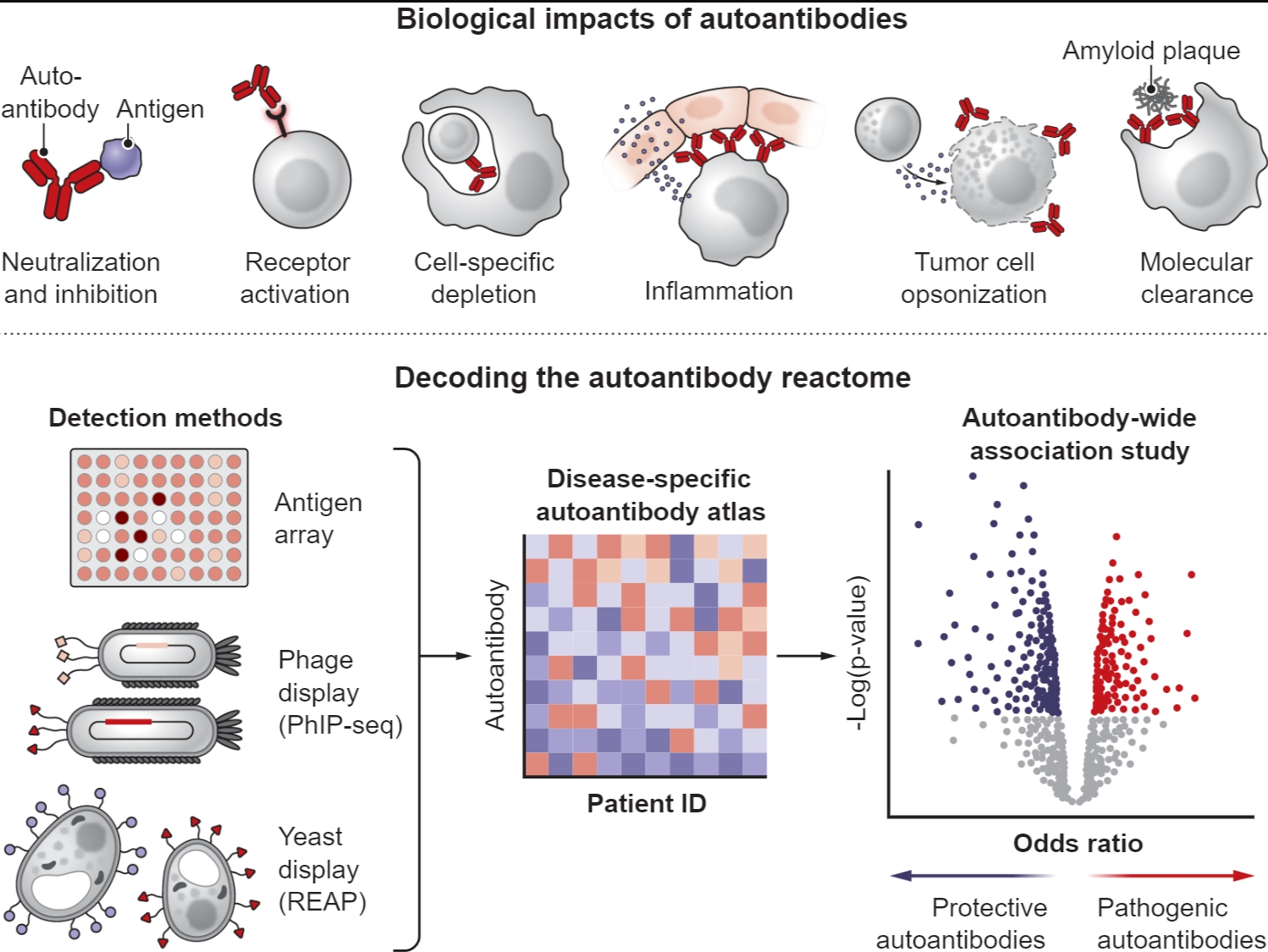
抗体由体液免疫系统产生,能够特异性结合几乎任何生物分子靶标(广义上称为“抗原”)(1)。虽然抗体的主要功能是提供针对病原体的适应性免疫,但总会出现一些与自身抗原结合的抗体。这些自身抗体会引起广泛的生物学效应,包括改变其靶标的活性和免疫调节(见图)。每个人都携带一系列不同的自身抗体——一种“自身抗体反应组”——为性状多样性提供了一条潜在的途径,反映了遗传差异影响表型的方式。
自身抗体通常因其在介导自身免疫性疾病中的病因学作用而广为人知。通常,自身抗体可驱动几乎任何组织内的病理性炎症,尤其是影响皮肤、关节、肌肉和中枢神经系统以及甲状腺和胰腺等器官 (2)。同样,自身抗体可以引发以高度特异性生物学效应为特征的独特综合征,类似于孟德尔单基因突变观察到的独特影响,因为它们会干扰体内的基本通路。值得注意的例子包括重症肌无力,一种由抑制乙酰胆碱受体的自身抗体引起的神经肌肉疾病,以及由激活促甲状腺素受体的自身抗体驱动的格雷夫氏病甲状腺功能亢进症。
不太受重视的是自身抗体的更微妙的表型效应,这些抗体可以改变疾病,甚至在临床上保持沉默,直到它们的活性在应激状态下被揭露。在 COVID-19 大流行期间发现了这种现象的一个关键示例,其中发现 I 型干扰素 (IFN-I) 中和自身抗体可使 COVID-19 死亡风险增加多达 200 倍 (3)。尽管在大多数情况下,IFN-I 自身抗体在临床上显然是沉默的,但随着年龄的增长,IFN-I 自身抗体的患病率急剧增加,在 70 岁以上的个体中达到 ~4% 的峰值 (4)。据估计,所有 COVID-19 死亡中有 20% 与 IFN-I 自身抗体的存在有关,这与其显著的临床影响和总体频率一致 (4)。这些发现强调了自身抗体能够揭示关键的生物学见解[例如,IFN-I在宿主对严重急性呼吸系统综合症冠状病毒2(SARS-CoV-2)的免疫中至关重要]以及自身抗体可能在人群中产生的深远影响。
然而,自身抗体并非都是有害的,在某些情况下,它们可能提供改善或预防疾病的保护作用。IFN-I自身抗体再次具有指导意义。系统性红斑狼疮 (SLE) 是一种自身免疫性疾病,其特征是 >50% 的患者 IFN-I 信号转导升高。有趣的是,~5% 的 SLE 患者具有中和 IFN-I 信号转导的自身抗体 (5)。与 COVID-19 相比,这些自身抗体与疾病活动度显著降低相关,可能是通过减弱病理性 IFN-I 通路功能 (5)。这种违反直觉的观察强调了自身抗体的二元性,证明了它们能够在它们通常与引起的疾病中赋予保护作用。
自身抗体的保护作用在许多疾病中都很明显。例如,长期以来,人们一直认为针对肿瘤相关抗原 (TAA) 的自身抗体的存在代表了多种癌症患者的阳性预后因素。多项研究已将 TAA 反应性自身抗体(例如各种上皮癌中的抗粘蛋白 1 (MUC1)和乳腺癌中的抗人表皮生长因子受体 2 (HER2))与患者更好的生存和复发结果联系起来 (6, 7)。据推测,这些自身抗体可引发免疫定向的肿瘤细胞杀伤,有助于改善肿瘤控制。在其他情况下,确定肿瘤反应性自身抗体的特异性分子靶标可鉴定出新的 TAA,包括 NY-ESO、MAGE、BAGE、GAGE 和 HOM-MEL-40 (8)。因此,癌症自身抗体为支持免疫系统在肿瘤监测中的作用提供了关键证据,并揭示了以前未确定的癌症治疗靶点。自身抗体可能对肿瘤有其他作用,例如调节治疗反应,但这需要进一步研究。
自身抗体对健康和疾病的影响
自身抗体可引发多种生物学效应,从而产生不同的健康结果,具有致病性和保护性临床效果。新兴的自身抗体发现技术,如抗原微阵列、噬菌体免疫沉淀测序(PhIP-seq)和快速细胞外抗原分析(REAP),现在使“自身抗体全关联研究”能够识别自身抗体反应组中存在的假定因果自身抗体,类似于全基因组关联研究。以这种方式鉴定的疾病修饰自身抗体可以阐明新的药物靶点,并为治疗开发提供模板。
神经退行性疾病中的自身抗体是有益自身反应性的另一个例子。识别淀粉样蛋白肽(淀粉样蛋白β的短片段,容易形成与神经退行性变有关的斑块)的自身抗体存在于健康个体中,并随着年龄的增长而减少,尤其是在阿尔茨海默病 (AD) 患者中 (9)。这一观察结果表明,这种抗体可以预防AD,并可能提供治疗益处。基于这些发现,已经开发出靶向淀粉样蛋白β肽的单克隆抗体,并发现在临床前 AD 模型和 AD 患者的临床试验中可促进脑内斑块清除并减缓认知能力下降 (10)。事实上,美国食品和药物管理局 (FDA) 最近批准的一种淀粉样蛋白β抗体 aducanumab 是从一组老年人中获得的自身抗体开发的,这些老年人没有表现出认知能力下降的迹象或表现出异常缓慢的认知能力下降 (10)。这表明,自身抗体不仅突出了潜在的治疗范式,而且在某些情况下,还可以作为治疗药物本身进行推进。
作为一个一般主题,自身抗体与健康结果的关联可以提供有关药物(什么基因产物)和何时药物(哪种疾病适应症)的关键信息。例如,SLE 中的保护性 IFN-I 阻断自身抗体似乎模仿了 anifrolumab(一种用于 SLE 的治疗性单克隆抗体,靶向 IFN-I 受体 IFNAR1)和 HER2 自身抗体在乳腺癌中的治疗益处,反映了曲妥珠单抗(一种用于治疗 HER2 恶性肿瘤的 HER2 单克隆抗体)的药理学 (5, 6).然而,潜在的治疗靶点不仅可以从保护性自身抗体中识别出来,而且可以从有害的自身抗体中识别出来。有害的自身抗体突出了其不受干扰的功能对于最佳健康结果所必需的途径,这意味着理想的治疗剂将发挥相反的效果。例如,尽管中和 IFN-I 的自身抗体会加剧 COVID-19 的严重程度,但与 IFN-I 具有相似生物学特性的重组 III 型干扰素的给药已显示出作为 COVID-19 治疗药物的前景 (11)。
值得注意的是,自身抗体的功能可以告知特定靶标应该如何被药物化(什么药理作用机制)。自身抗体可以被概念化为天然生物药物,对人体生理机能具有非凡的潜在影响。例如,直接激活或抑制信号转导受体,稳定和延长配体的循环半衰期,或促进其清除 (2)。此外,自身抗体可通过与免疫效应细胞上表达的 Fc 受体相互作用来发挥免疫调节功能,从而驱动抗体定向细胞介导的细胞毒性 (ADCC)、吞噬作用 (ADCP) 或补体定向杀伤 (CDC),从而耗尽在其表面表达靶抗原的细胞 (1)。因此,将自身抗体与临床关联的知识与对其功能的理解相结合,可以开发全面的治疗假设,将药物靶点与特定的治疗适应症和潜在的作用机制联系起来。
尽管自身抗体可以发挥巨大的临床作用,并为治疗开发提供见解,但它们对生理学的影响可能被低估了。这可能是因为没有全面的调查来确定自身抗体在蛋白质组范围内在整个人群中的常见程度。这一挑战的核心是缺乏用于无偏倚、高通量自身抗体检测的实验工具。因此,疾病修饰性自身抗体主要是通过已知生物学的假设驱动方法或通过通量和可扩展性有限的具有挑战性的实验技术发现的。然而,下一代自身抗体检测方法的出现代表了一个重大突破,能够对不同人群的人类自身抗体进行深入和高通量的研究。
全面检测自身抗体的开创性工作受到基因组技术进步的启发。在 DNA 阵列成功的基础上,自身抗原微阵列实现了能够筛选数千种抗原的自身抗体的高度多重检测 (12)。下一代测序 (NGS) 技术的出现促进了噬菌体免疫沉淀测序 (PhIP-seq) 等新方法的出现,该技术使用基因编码的噬菌体展示文库来呈现长度为 ~50 个氨基酸的多种肽“图块” (13)。可以筛选这些自繁殖噬菌体文库与患者样本中存在的自身抗体结合,从而有效地将自身抗体-抗原结合转化为具有蛋白质组级深度的高通量测序读数。然而,PhIP-seq和相关的肽显示技术并不能捕获正确折叠的“构象”抗原,而这些抗原是许多自身抗体的靶标。已经开发了其他技术来弥补这一差距。一个例子是快速胞外抗原分析 (REAP),它类似于 PhIPseq,但利用酵母酿酒酵母表达和显示细胞外和分泌蛋白的全长胞外结构域的能力 (14)。最终,目前没有一种技术可以对所有自身抗原进行采样,但总的来说,它们可以检测出很大一部分自身抗体反应组。
PhIP-seq 和 REAP 已被用于共同揭示多种疾病适应症以及健康个体中的数千种自身反应性。正如人类基因组已被测序以注释整个基因组的突变一样,考虑到类似的原理可能适用于人类蛋白质组和自身抗体是很诱人的:对于每种蛋白质,都可能有具有功能性自身抗体的个体影响该蛋白质的活性和/或行为。高度可扩展的自身抗体检测技术的出现现在允许以与DNA测序技术实现全基因组关联研究相同的方式进行“自身抗体全关联研究”。这些努力有望确定对健康具有假定因果影响的自身抗体,从根本上解码“自然临床试验”,其中可以识别出对疾病有意义影响的内源性药物(自身抗体)。
要实现自身抗体全关联研究的前景,需要解决自身抗体生物学固有的挑战。一个主要挑战是自身抗体多样性本身。尽管已经观察到数千种不同的自身抗体类别,但在 PhIP-seq 和 REAP 数据集中看到的个体自身反应性通常很少见,通常存在于 <1% 的人群中 (15)。因此,要获得检测显著自身抗体临床关联的统计功效,可能需要对每个适应症的数千名患者进行大规模队列研究。另一个挑战是自身抗体动力学。自身抗体不会在个体的整个一生中出现,通常在成年期出现。纵向研究表明,一些自身抗体反应可以持续数年,正如在 SLE 患者中观察到的 IFN-I 自身抗体一样 (5)。相比之下,其他自身抗体反应是短暂的,如在SARS-CoV-2感染过程中出现并在数周的时间尺度上消退的一些自身反应性所见(15)。因此,自身抗体的不同时间差异在确定其与疾病的因果关系方面带来了复杂性。此外,自身抗体应答通常由抗体谱系的多克隆混合物组成,这些抗体谱系可能具有随时间演变的不同功能 (2)。自身抗体效应子功能也可能发生动态改变,这是由于抗体同种型、亚类和翻译后 Fc 修饰的变化 (1)。
这些挑战也为未来的研究提供了令人信服的机会,以了解自身抗体的独特方面及其广泛的功能。最终,不断发展的自身抗体研究领域有望为生物医学创新开辟新的视野,使发现能够从我们自己的免疫系统中汲取灵感。
https://blog.sciencenet.cn/blog-41174-1421812.html
上一篇:大型智能生物反应器【科学】
下一篇:铁介孔碳纳米颗粒实现氢光热协同治疗