博文
海底热泉好氢气微生物培养方法
|
海底热泉,是指海底深处的喷泉,原理和火山喷泉类似,喷出来的热水就像烟囱一样,发现的热泉有白烟囱、黑烟囱、黄烟囱。1979年,美国科学家比肖夫博士首次在太平洋2500米接近海底时,看到这一奇异的景象:蒸汽腾腾,烟雾缭绕,烟囱林立。经过仔细观察发现在"烟囱林"中有各种生物生存。在海底热泉生态系统中,自养微生物是非生物能源进入生态系统的入口,但研究这些微生物最困难的是成功地人工培养。
这是一篇探索如何培养海底热泉周围细菌方法的研究论文,请大家注意的是,这种培养方法最重要的是提高高浓度氢气环境,这也是海底热泉周围海水的特殊环境内涵,也是这些细菌生存的重要环境因素。
Muto H, Miyazaki J, Sawayama S, Takai K, Nakagawa S. A Simple and Effective Method for Solid Medium Cultivation of Strictly Hydrogen- and Sulfur-oxidizing Chemolithoautotrophs Predominant in Deep-sea Hydrothermal Fields. Microbes Environ. 2023;38(6).
严格氢氧化和硫氧化的化学自养细菌,特别是弯曲杆菌门和Aquificota门的成员,在深海热液田中具有世界性分布。这些微生物在液体培养基中的成功培养提供了对其生理、进化和生态特征的见解。值得注意的是,最近对硫单胞菌属(弯曲杆菌属)和珀尔塞芬氏菌(Aquificota)的种群遗传研究揭示了其种群的地理隔离。该研究领域的进展很大程度上取决于纯培养物的可用性,这需要劳动密集型的液体培养程序,例如稀释至灭绝,因为长期以来的假设是,许多严格或兼性厌氧的化学石自养生物不容易在固体培养基上形成菌落。我们在此描述了一种简单且具有成本效益的方法,用于在固体培养基上培养这些化学自养生物。结果表明,不仅胶凝剂的选择,而且气相组成对不同实验室菌株的菌落形成率都有显著影响。使用结冷胶作为胶凝剂,结合高浓度的氢气和二氧化碳在一个袋子里促进了菌落的形成。这与在琼脂固化培养基上没有形成菌落形成鲜明对比,其中硫代硫酸盐作为电子供体,硝酸盐作为电子受体,碳酸氢盐作为碳源,放置在厌氧罐中,置于氮气下的厌氧罐中大气层。我们的方法有效地从深海喷口样品中分离出化学自养生物,强调了其在需要纯氢和硫氧化化学自养生物培养物的研究中的潜在价值。
深海热液喷口是主要由化学自养微生物推动的非常多产生态系统所在地。这些微生物利用排气液中无机化合物的化学能来转化二氧化碳变成有机化合物。硫和/或氢氧化化学自养生物,特别是弯曲杆菌门和Aquificota门的成员,在这些生态系统中广泛存在,在碳、硫和氮循环中发挥着重要作用。为了更详细地了解它们的生理和生态特性,这些微生物的纯培养物是从世界各地的深海喷口获得的,通常采用液体介质和稀释至灭绝方法。尽管使用琼脂或结冷胶固化培养基衍生出的菌株数量有限,各种因素(如胶凝剂、培养基制备程序和孵育条件)对这些微生物的影响尚不清楚。这表明有可能进一步提高固体培养基培养策略对深海喷口化学自养生物的功效。
与液体培养相比,固体培养提供了几个优点。它通过形成菌落简化了环境微生物的分离和维护,便于从单个样品中同时分离出多种菌株。胶凝剂的选择显著影响微生物在固体培养基上的生长。虽然琼脂常用于标准的微生物学实验,但已知它会抑制许多微生物的生长。结冷胶或PhytagelTM是一种替代胶凝剂,已被证明可以增强一些生长缓慢的微生物的生长。它还已成功用于深海喷口高温厌氧古菌的培养。此外,发现固体培养基的制备方法会影响菌落形成比例。以前的研究显示,高压灭菌琼脂和其他培养基成分会抑制微生物生长,可能的原因是产生过氧化氢。
因此,本研究的目的是建立一种简单有效的深海喷口化学自养微生物的固体培养技术,而无需专门的昂贵设备。为实现这一目标,我们的方法包括两个主要实验策略:为了验证该方法,我们在固体培养基上培养了化学自养微生物的实验室菌株并量化了菌落形成速率;然后通过在固体培养基上孵育深海喷口样品来证实我们提出的方法的有效性。
材料与方法
在这项研究中,我们选择了三种深海热液喷口化学自养菌:Sulfurimon在这项研究中,我们选择了三种深海热液喷口化学自养菌:Sulfurimonas autotrophica OK10T、Sulfurovum sp. NBC37-1和Nitratiruptor sp. SB155-2,以及一种Aquificota:Persephonella hydrogeniphila 29WT。S. autotrophica OK10T是一种严格需氧的硫氧化嗜温菌。Sulfurovum sp. NBC37-1和Nitratiruptor sp. SB155-2能够利用氢和硫化合物作为能量来源。P. hydrogeniphila 29WT是一种严格需氢的嗜热菌。这些菌株通常在液体改良MMJHS培养基中于氢气/二氧化碳(80:20)条件下、25°C(S. autotrophica OK10T)、33°C(Sulfurovum sp. NBC37-1)和55°C(Nitratiruptor sp. SB155-2和P. hydrogeniphila 29WT)下进行培养。原始MMJHS培养基包含以下成分(L–1 MMJ合成海水):1 g硝酸钠,1 g碳酸氢钠,1 g五水亚硫酸钠,和10 g硫。在本研究中,通过去除元素硫并增加至3 g硫代硫酸盐以增强菌落的可见度并促进分离物的生长来改良该培养基。
固体培养基制备
使用1.5%(w/v)琼脂(Fujifilm Wako Pure Chemical)或0.5%(w/v)结冷胶(Nacalai Tesque)将改良的MMJHS培养基固化。制备了四种不同的溶液(A至D),如下所示:溶液A含有双浓缩MMJ合成海水;溶液B,3%(w/v)琼脂;溶液C,1%(w/v)结冷胶;溶液D,5%(w/v)碳酸氢钠和硝酸钠以及15%(w/v)亚硫酸钠·5hydrogenO。使用这些溶液,我们制备了四种不同类型的固体培养基进行评估:(1)“琼脂高压灭菌”培养基,通过将相同体积的高压灭菌溶液A和B无菌混合制备;(2)“琼脂过滤”培养基,通过将相同体积的过滤灭菌溶液A和高压灭菌溶液B混合制备;(3)“结冷胶高压灭菌”培养基,通过将相同体积的高压灭菌溶液A和结冷胶混合制备;(4)“结冷胶过滤”培养基,通过将相同体积的过滤灭菌溶液A和高压灭菌溶液C混合制备。在Split Petri Dish(4个部分)(VMR International)中固化之前,向所有培养基中加入等量的过滤灭菌溶液D。如前所述测量固体培养基中过氧化氢的产生。此外,将Nitratiruptor sp. SB155-2接种到用1.5%(w/v)洗涤琼脂固化的改良MMJHS培养基上。在这种“洗涤琼脂”培养基中,通过超声处理60 分钟并用过滤器(孔径为10 μm)过滤将琼脂洗涤在Milli-Q水中并回收。
固体培养基评估
从在液体改良MMJHS培养基中生长的培养物中制备细菌接种物,培养24小时。然后将细胞悬浮在经过滤灭菌的MMJ合成海水中,浓度在104–108 cells mL–1之间。每个稀释系列点接种到固体培养基上,使用1 μL悬浮液(每个点含10–105个细胞)进行四到五次重复,覆盖整个Petri皿的所有部分。接种后,将皿放入袋中(Mitsubishi Gas Chemical),连同一个AnaeroPouchTM-MicroAero(Mitsubishi Gas Chemical)一起。然后冲洗并填充由过滤灭菌的氢气/二氧化碳混合物组成的混合物(80:20或50:50 [v/v])。对于嗜温菌,还测试了氢气/二氧化碳(25:75)的气体混合物。为了防止培养基干燥,将一份高压灭菌的KimWipe润湿在Milli-Q水中并放入袋中。此外,对于在55°C下孵育的情况,用Ziploc塑料袋进一步封闭袋装袋。使用紧凑pH计(AS-212; Horiba)测量每种固体培养基在不同气体条件下的pH值。简要地说,通过将每个固体培养基推入针孔中,然后倒入Petri皿中并将其放入袋中,将每个固体培养基均质化。在相应的氢气/二氧化碳气体条件下孵育培养基24小时。孵育后,立即将均质化的培养基从袋中取出并放在pH计上进行测量。在上述温度下孵育至少12天。在此期间,每12或24 小时拍摄一次培养基图像。Sulfurovum sp. NBC37-1和Nitratiruptor sp. SB155-2接种到“琼脂高压灭菌”培养基上并在GasPakTM瓶(BD BBL)中孵育以进行比较,同时处于氮气气氛下。
环境样品在固体培养基上的培养
使用来自日本冲绳县宫古市野原站点(27°31.386'N, 126°59.209'E)Noho点的活跃烟囱结构泥浆样品作为接种物,深度为1,550 m,使用ROV Hyper-Dolphin(Dive#1860)在JAMSTEC巡航NT15-13期间于2015年采集。将样品一式两份接种到“琼脂过滤”和“结冷胶过滤”培养基上。测试的气体条件为氢气/二氧化碳(80:20)和氢气/二氧化碳(50:50)。在55°C下孵育皿2–3 周。每天监测菌落形成情况,并对菌落进行直接PCR扩增16S rRNA基因,使用先前描述的引物27F和1492R 。如前所述进行桑格测序。生成的序列使用GeneStudio ver 2.2.0.0(GeneStudio)组装并与现有数据库通过BLAST搜索算法进行比较。获得的16S rRNA序列已提交至GenBank/EMBL/DDBJ数据库,登录号为LC775602–LC775696。
结果与讨论
厌氧罐中的培养
硫杆菌属NBC37-1和硝化杆菌属SB155-2都不能在GasPakTM罐中N2气氛下的“高压灭菌琼脂”培养基上形成菌落(数据未显示),这是厌氧菌的典型培养策略。虽然深海喷口占主导地位的化能自养生物通常利用氢和硫化合物作为电子供体,但它们在仅依靠硫化合物时通常生长受限。因此,在本研究中,我们使用装有含氢气体的袋来培养这些微生物。这些袋子不仅成本低、节省空间,其物理灵活性也便于气相的更换/控制。
固体介质上的生长
各菌株在固体介质上的生长概述如图1和电影S1所示。所有菌株在果胶胶凝介质(下图)上的生长速度都比在琼脂胶凝介质(上图)上的生长快,即使接种点更稀疏。只有S. autotrophica OK10T在琼脂胶凝介质上生长,且在琼脂过滤介质上的生长比在琼脂高压灭菌介质上快(图1A和电影S1)。值得注意的是,只有这个菌株最初是用琼脂胶凝介质分离出来的,而其他菌株是通过液体介质稀释到灭绝技术获得的。尽管被描述为严格需氧,S. autotrophica OK10T在这些条件下表现出生长。培养基中没有还原剂,这意味着该菌株利用培养基中的溶解氧进行呼吸。以前的研究表明,琼脂胶凝介质上的微生物生长受到过氧化氢产生的抑制。然而,在目前的研究中,所有测试的培养基中的过氧化氢都低于可检测限(数据未显示)。这可能是由于培养基中的硫代硫酸盐作为能量来源。

Fig. 1.实验室菌株在固体培养基上的生长。(A)硫自养硫杆菌OK10T在25°C下培养84小时;(B)硫化杆菌属NBC37-1在33°C下培养180小时;(C)硝化杆菌属SB155-2在55°C下培养132小时;(D)嗜氢热泉菌29WT在55°C下培养60小时。每种菌株的实验中,都有三个培养皿,从左到右分别标记二氧化碳浓度(20%,50%,75%[v/v])。每个培养皿的左上角和右上角部分分别包含琼脂高压灭菌和琼脂过滤培养基,而底部左侧和右侧部分则包含果胶胶凝高压灭菌(左)和过滤(右)介质。接种点细胞的数目从10到104不等,每个接种点重复四次。请参考电影S1以获得相应的延时视频。
由于氢/二氧化碳气体混合物被建议用于固体培养基上促进微生物生长,我们进一步研究了气体成分对菌株生长的影响。测试了含氢/二氧化碳80∶20、50∶50和25∶75的V/V型菌株( S . autotrophica OK10T ) (未公布数据),除S . autotrophica OK10T外,所有菌株都表现出更快的生长和在高二氧化碳浓度下的明显的生长延缓( Movie S1 )。相反,高二氧化碳浓度抑制了S . autotrophica OK10T的生长( 图1A和 Movie S1 ) 。尽管其机理尚不清楚,但一些古氏盐杆菌属类群偏好于高二氧化碳浓度。鉴于深海出口具有丰富的碳源以及利用二氧化碳作为唯一碳源的深海古氏盐杆菌,可以想象二氧化碳气体增强了它们的生长。另一种可能解释二氧化碳浓度影响的原因可能是媒体pH值和/或二氧化碳-碳酸氢根离子平衡。在氢/二氧化碳(80∶20 ) 、50∶50和25∶75中的pH值分别是6.5、6.0和5.7。进行比较可知,S . autotrophica OK10T、Nitrator sp . NBC37-1(未公布数据)和P . hydrogeniphila 29WT的菌株生长pH范围分别为4.5–9.0(最佳pH6.5)、5.3–7.5(最佳pH6.0)、5.2–7.5(最佳pH6.0)和5.5–7.6(最佳pH7.2)。由于这些菌株的pH范围都在这些菌株的生长pH范围内,因此以pH为单一参数不能完全解释在细胞壁形成性质上的差异。在这些pH范围内,随着媒体pH的降低,溶解的碳酸氢根离子和二氧化碳浓度预计会减少和增加。因此,在高二氧化碳浓度下,固体媒体表面的溶解的二氧化碳量可能会增加。目前尚不清楚Aquificota和Cactola是否使用二氧化碳或碳酸氢根作为还原型TCA循环中的碳源;然而,取决于媒体的pH和气体中二氧化碳浓度的比例,可能影响了它们的碳固定速率和生长。
凝胶凝剂、灭菌方法和气相组成对菌落形成率的影响
为了定量评价凝胶凝剂、灭菌方法和二氧化碳浓度的影响,我们测量了硝化菌的菌落形成率(菌落数与接种细胞数量的比值)。SB155-2和嗜氢疟原虫29WT。我们选择这些菌株是因为它们的快速和一致的菌落形成。高压灭菌菌之间的菌落形成率没有显著差异(图。S1)和过滤(图2)介质(P>0.1的学生t检验)。氢/二氧化碳(50:50)、结冷胶(80:20)、琼脂(50:50)和琼脂(80:20)下的菌落形成率略有下降(图2和S1)。
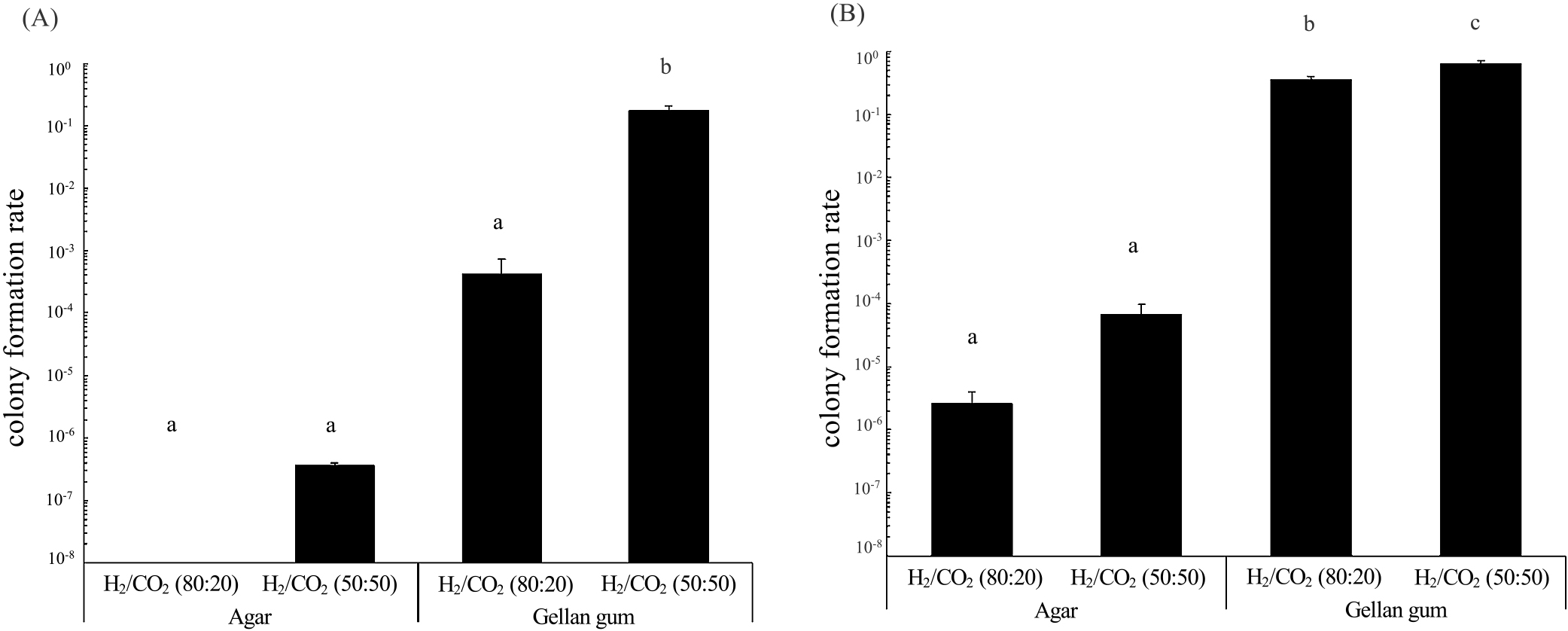
Fig. 2.在相同的气体条件下,Nitratiruptor sp. SB155-2和P. hydrogeniphila 29WT在Gellan gum固化介质上的菌落形成率高于琼脂糖固化介质上的菌落形成率。在氢/二氧化碳(50:50)气体下,Gellan gum固化介质导致Nitratiruptor sp. SB155-2的菌落形成率显著高于其他条件,达到最高的菌落形成率1.7×10^-1(图2A)。同样,P. hydrogeniphila 29WT在Gellan gum高压灭菌介质下的氢/二氧化碳(50:50)显示出较高的菌落形成率(S1B)。在氢/二氧化碳(50:50)气体下的Gellan gum过滤介质显示出P. hydrogeniphila 29WT的最高菌落形成率,高达6.3×10^-1(图2B)。当与Gellan gum和氢/二氧化碳(50:50)气体结合时,这些菌株的菌落形成率至少比最低菌落形成率高105倍。这些结果表明,胶凝剂和二氧化碳浓度对菌落形成率的影响大于灭菌方法,而且Gellan gum对Nitratiruptor sp. SB155-2和P. hydrogeniphila 29WT的培养都有利。此外,二氧化碳气体浓度影响了Nitratiruptor sp. SB155-2和P. hydrogeniphila 29WT的菌落形成率,尤其是Nitratiruptor sp. SB155-2,其菌落形成率显著增加。如图1的电影和菌落形成率(图2和S1)所示,Nitratiruptor sp. SB155-2和P. hydrogeniphila 29WT的生长受到更高二氧化碳浓度的促进。为了获得关于固体培养基上生长模式和二氧化碳浓度对菌落形成影响的更详细理解,需要进行类似于转录组研究的详细分析。
文章还研究了琼脂洗涤对Nitratiruptor sp. SB155-2菌落形成率的影响。Nitratiruptor sp. SB155-2在未洗涤的琼脂糖介质和洗涤过的琼脂糖介质上进行培养。洗涤过的琼脂糖介质上的菌落形成率高于未洗涤的琼脂糖介质,分别为5.4×10^-5和3.6×10^-7。尽管洗涤琼脂糖促进了菌落的形成,但凝胶胶凝剂介质上的菌落形成率(图2),仍为1.7×10^-1,超过了洗涤过的琼脂糖介质。以前的研究表明,琼脂糖固化介质上菌落形成的抑制是由于商业琼脂粉中的游动抑制剂的存在,或者是由于在高压灭菌含有磷酸盐的琼脂时产生过氧化氢。在这项研究中,我们证明了延迟生长(图1和电影S1)和低菌落形成率(图2)至少在部分上是由于商业琼脂粉中的水溶性抑制剂。这些抑制剂可能通过简单的水洗很容易去除。需要进一步的研究来鉴定这些特定的抑制剂并阐明阻碍在琼脂培养基上生长的化学自养细菌的机制。
文章还对深海样品进行了培养。将深海热液喷口样品接种到固体培养基上,以评估胶凝剂和气体组成对环境微生物群落的影响。他们将相当于约20毫克(湿重)的烟囱结构的100微升烟囱泥浆接种到固体培养基上。以前的基于RNA的分析揭示了这种样品中丰富多样的Campylobacterota的优势地位。在琼脂糖固化介质上,在氢/二氧化碳(80:20)的气氛下没有观察到菌落,而在氢/二氧化碳(50:50)的气氛下经过14天的55°C培养后形成了四个菌落(图3)。这些菌落在其16S rRNA基因序列中至少有99%与从东太平洋海隆分离出的属于Campylobacterota门类的中度嗜热化学自养生物Nitrosophilus labii相似。
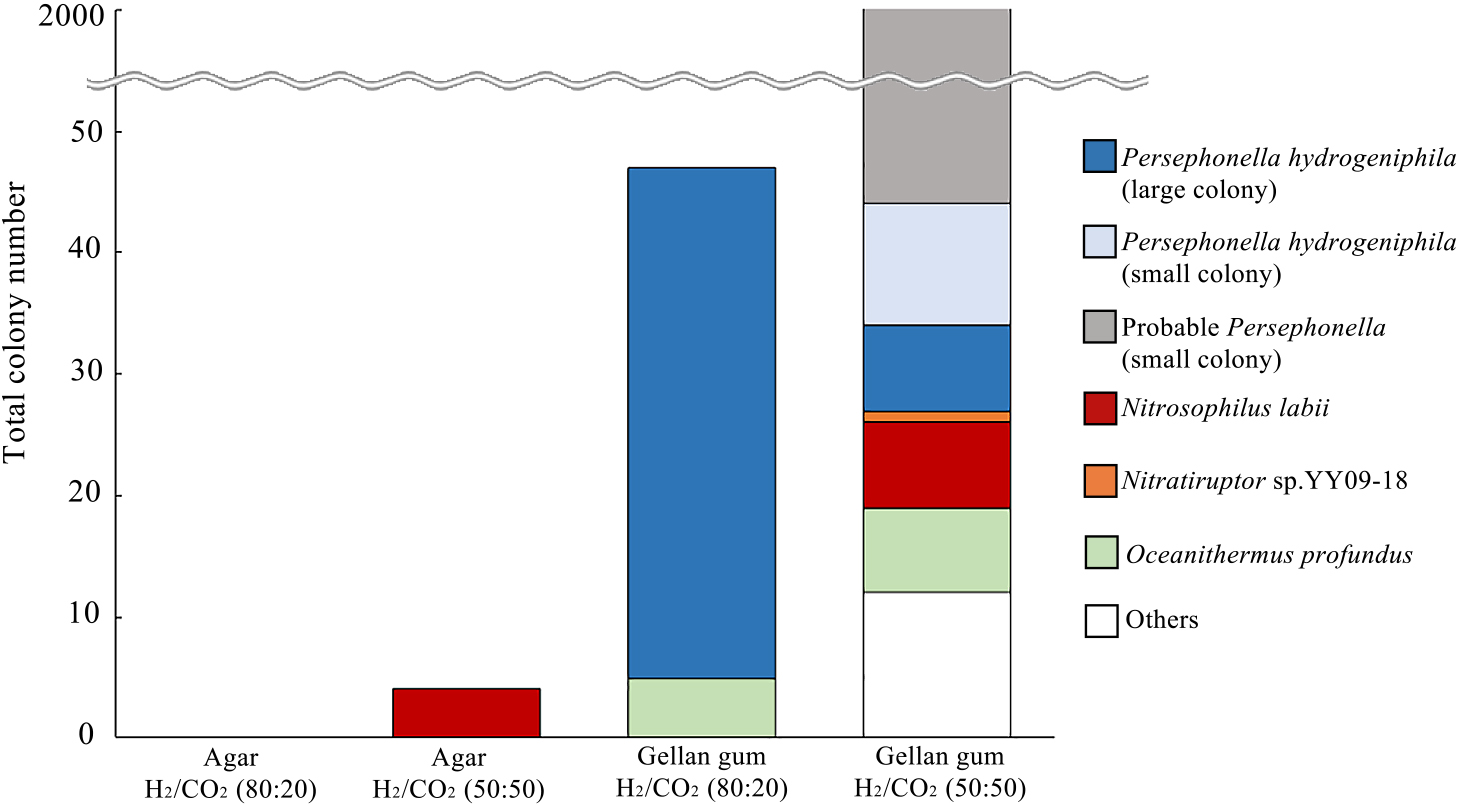
本研究利用胶凝糖胶固化培养基对深海热液环境中的化学自养菌进行了培养。结果显示,在氢气/二氧化碳(80:20)的气氛下,有47个菌落形成,它们的16S rRNA基因序列与氢嗜酸菌(42个分离物)和海洋硝化菌(5个分离物)的相似性至少为98%。值得注意的是,在这些培养条件下没有发现Campylobacterota菌落。在氢气/二氧化碳(50:50)的气氛下,胶凝糖胶固化培养基显示出最高的菌落形成能力,产生了超过2000个不同大小的菌落。大菌落(直径大于1毫米)被鉴定为硝化菌(7个菌落)、硝化裂解菌(1个菌落)、Persephonella(7个菌落)、海洋硝化菌(7个菌落)、Kyrpidia(8个菌落)、芽孢杆菌(3个菌落)和嗜气杆菌(1个菌落)(表S1)。严格异养菌(即芽孢杆菌、嗜气杆菌和海洋硝化菌)在胶凝糖胶培养基上的生长可能是由于胶凝糖胶作为能量和/或碳源的使用。值得注意的是,这些异养生长的速度比自养生长的慢。
鉴于形态上的相似性,我们对超过2000个小菌落中的10个进行了检查。每个菌落都与氢嗜酸菌高度相似(表S1),这表明剩余的菌落也属于Persephonella属。这与Persephonella实验室分离物在较高二氧化碳浓度下胶凝糖胶培养基上增强的菌落形成一致。然而,我们观察到一个不一致的地方,尽管氢嗜酸菌29WT在氢气/二氧化碳(80:20)的气氛下表现出较高的菌落形成率,但小Persephonella菌落并没有从烟囱样品中出现。这种差异可能是由于长期保存的环境样品中Persephonella细胞的休眠状态,这可能需要更高的二氧化碳浓度才能恢复和生长。
虽然这些分离物的分类新颖性并不明显,但我们获得了大量来自硝化菌属、硝化裂解菌属和Persephonella属的化学自养菌。这些细菌之前只能在液体培养基中培养。我们的简化培养方法首次成功地使它们在固体培养基上形成菌落。
结论
本研究表明,通过使用胶凝糖胶和填充氢气/二氧化碳气体混合物的袋来优化深海热液环境中化学自养菌的培养,从而消除了对专业设备(如厌氧手套箱)的需求。虽然检测到一些异养生物的警告,但这种新的直接方法有效地从深海热液场中分离出了化学自养微生物。虽然本研究没有产生系统发育上新颖的化学自养菌,但提高菌落形成效率对于超越分类学的原因具有重要意义。我们的方法能够从单一样品中获得同一物种的大量分离物,增强了其在进行生物地理和生态分析方面的效用,使其成为一项有价值的工具。此外,我们的方法为未来关于深海热液化学自养菌的研究提供了一种实用的技术。它在菌落形成方面的效率可能会加速这些微生物的基因改造程序的发展。
https://blog.sciencenet.cn/blog-41174-1414432.html
上一篇:阿尔茨海默病的免疫疗法
下一篇:天然氢形成原理未来希望和谜题