博文
阿尔茨海默病的免疫疗法
|
阿尔茨海默病的免疫疗法已经取得了一定成功,标志就是三种单抗成功进入临床应用。免疫疗法的有效也证明了Aβ 沉积假说的可靠性。但是这种方法效果也是有限的,只对早期患者有效,这说明阿尔茨海默病的病理过程非常复杂,距离真正解决问题仍然存在很大差距。
三种单克隆抗体(aducanumab、lecanemab 和 donanemab)靶向大脑中的淀粉样蛋白β (Aβ) 沉积,可减缓早期阿尔茨海默病 (AD) 的认知和功能下降 (1–3)。在症状轻微的AD患者中进行的3期临床试验数据表明,减少Aβ具有适度的临床益处。这支持了淀粉样蛋白级联假说 (ACH) 的核心原则,该假说提出 Aβ 沉积物在 AD 中起因果作用。然而,他们也表明,在疾病的症状阶段靶向 Aβ 沉积并不是万能的——这一发现与 Aβ 聚集在 AD 发病机制中的假定起始作用一致。此外,这些研究强调了成像和液体生物标志物在开发AD疾病修饰疗法(DMT)中的关键作用。
Immunotherapies for Alzheimer’s disease | Science
几十年来,靶向 Aβ 一直是开发 AD DMT 的基础方法 (4)。在各种治疗方法的多次临床失败之后,Aβ作为靶点和ACH的支持者担心,靶向Aβ可能被证明是不可行的,即使它确实在AD中发挥了开创性的触发作用。此外,许多人担心在存在大量神经退行性变的 AD 症状期靶向 Aβ 可能不会带来益处 (5)。事实上,Aβ 聚集和沉积在症状发作前 2 至 3 年开始 (6),随后发生其他病理变化,包括过度磷酸化 tau 蛋白的积累。
在由 AD 引起的极早期认知障碍患者中,aducanumab、lecanemab 和 donanemab 远未治愈,但它们都在 18 个月内将认知能力下降减缓了 ~25% 至 30%。这些治疗还与 AD 病理学生物标志物的显着降低有关,包括脑淀粉样蛋白正电子发射断层扫描 (PET) 和脑脊液或血浆中磷酸化 tau 的浓度 (2, 3)。这些单克隆抗体具有一些区分特性 (7)。然而,它们具有优先结合沉积的 Aβ 并激活免疫清除机制的能力(见图)。这些共同特性可能是它们对AD生物标志物和临床进展的影响以及不良反应的基础。鉴于缺乏对可溶性 Aβ 具有特异性的抗体的疗效,选择性靶向沉积的聚集 Aβ 似乎是疗效的必要条件,尽管靶向寡聚组装体仍可能在治疗中发挥作用。与单体相比,Aducanumab 和 lecanemab 以更高的亲和力结合 Aβ 聚集体。Donanemab 靶向富含 Aβ 沉积物的 Aβ 物种中的焦谷氨酰胺修饰。每种抗体的试验结果相似多于不同(减缓速度相差<10%),因此很难断定治疗在临床效果方面是否真正不同,或者抗体结合特性以外的因素是否影响了临床试验数据的相对强度。这些抗体的未来研究可以揭示不同的生物学特性是否介导长期疗效的差异。
这些试验提供了强有力的证据,证明在早期症状性AD中减少脑Aβ具有积极但适度的临床效果。donanemab 试验的数据显示,47% 的接受治疗的受试者在疾病早期阶段 1 年后没有临床进展,而安慰剂组为 29%(2)。然而,根据 PET 成像评估,尽管 Aβ 沉积物几乎完全消除,但平均而言,尽管 Aβ 沉积物几乎完全消除,但治疗期间由 Aβ 聚集体积累引发的其他病理会自我强化,这一观点得到了以下观察的支持 (8)。
aducanumab、lecanemab 和 donanemab 在 AD 中的临床成功现在引发了许多问题。例如,早期治疗会有更大的效果吗?如果 Aβ 沉积是致病触发因素,那么在 AD 的其他病理特征出现之前清除 Aβ 沉积物应该是一种有效的预防性(预防性)治疗。donanemab 3 期研究的数据可能提供一些线索,因为成像生物标志物用于评估两组确诊脑 Aβ(Aβ 阳性)的参与者,一组具有低至中等数量的病理性 tau 沉积物,另一组具有大量 tau 沉积物 (2)。与高 tau 蛋白组相比,低至中度 tau 蛋白组的治疗效果更好。这些数据表明,对病理负担较重的患者进行治疗效果较差。那么,更早的治疗会更好吗?lecanemab 和 donanemab 的初步预防试验主要针对 Aβ 阳性、血质正常的个体进行。
来自aducanumab、lecanemab和donanemab的3期试验的大多数数据都揭示了治疗18个月期间的变化。可以设想超过18个月的几种可能性。在最好的情况下,治疗组和安慰剂组之间的下降斜率继续存在分歧。因此,在 18 个月时下降 ~25% 可能会转化为 3 年时下降 ~50%。一个不太乐观的情况是,在 18 个月时观察到的益处是稳定的,但之后,下降会像安慰剂组一样继续。第三种情况是效果是短暂的,18个月后,治疗组和安慰剂组之间的差异会缩小。真实世界的临床经验将有助于区分这些可能性。在美国,有关接受抗体的个人的数据正在登记处收集。
跟踪治疗的总体效果很重要,但评估更个体化的变化也很重要。在癌症中,许多药物被批准对总生存期的影响不大,但随着时间的推移,数据显示,在已治愈或处于长期缓解的特定个体中,有异常的反应。那么,这些免疫疗法是否有类似的反应者,他们在很长一段时间内表现出很少的认知能力下降?鉴于早期症状性AD下降速度差异很大,这个问题的答案可能需要多年的随访。个体和亚组的长期影响和反应分析将严重影响这些药物疗效和患者选择的整体观点。
这些抗体的安全性如何?所有这些都与异常脑磁共振成像结果的增加有关。这些被称为两种类型的淀粉样蛋白相关影像学异常 (ARIA):ARIA-E(脑实质水肿或脑虚积液,即沿脑沟间隙的软脑膜外渗液体)和 ARIA-H(由红细胞分解产物引起的含铁血黄素沉积,即微出血)(9)。尽管抗体治疗会增加 ARIA 的发生率,并且在大约三分之一的接受治疗的参与者中观察到,但在大多数人中,它是无症状的。如果确实出现症状(例如,在donanemab 3期研究中,6%的接受治疗的受试者),这些症状通常是轻微的(例如头痛、意识模糊或头晕)。然而,在极少数情况下,会出现更严重的后果(例如,<1% 的接受治疗的受试者出现大出血),并且一些死亡归因于抗体诱导的严重 ARIA (10)。在三种抗体的所有临床试验中,ARIA 在治疗的前 6 个月更常见,但可能稍后发生,携带载脂蛋白 E (APOE) 基因 ε4 等位基因的个体的发病率大约高出 3-6 倍 (1-3)(AD 最常见的遗传危险因素)。
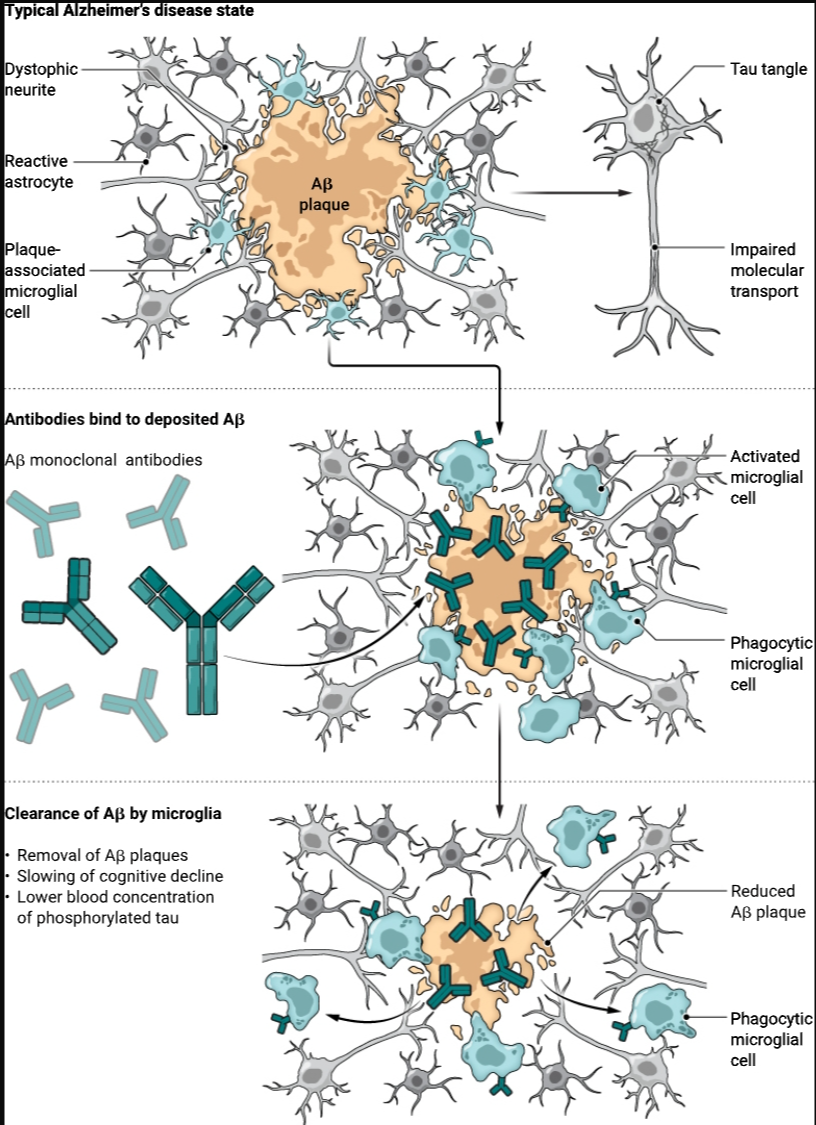
抗体介导淀粉样蛋白β的去除。在阿尔茨海默病中,淀粉样蛋白-β (Aβ) 的沉积会引发一系列复杂的事件,包括 tau 病理学的发展,并导致神经退行性和认知障碍。通过正电子发射断层扫描评估,用单克隆抗体靶向 Aβ 可降低脑 Aβ 浓度,并适度减缓早期症状性阿尔茨海默病患者的认知能力下降。这些抗体还可以降低血液中磷酸化tau蛋白(阿尔茨海默病的生物标志物)的含量。在机制水平上,抗体被认为诱导小胶质细胞清除斑块,尽管这尚未得到证实。
ARIA的生物学机制是什么,可以预测和预防吗?靶向 Aβ 的抗体试验数据表明,ARIA 可能是脑血管系统中 Aβ 沉积物的抗体结合以及免疫级联反应的激活的结果,或者随着 Aβ 的清除,血管可能减弱。不结合 Aβ 沉积物或效应功能降低的 Aβ 靶向抗体不会增加 ARIA 的发生率 (4)。需要进一步的研究来了解ARIA的生物学机制以及它是否与Aβ清除有关。
是否有可能通过使用生物标志物和遗传数据来识别最有可能从治疗中受益的个体,从而优化 DMT 治疗 AD 的临床实施?答案是肯定的。根据通过生物标志物确定的疾病分期和遗传风险因素(APOEε4 状态)对患者进行分层,提供了明确的证据,表明个体化的疾病分期会影响治疗的整体效果大小。这些生物标志物还告知副作用的风险、靶点参与和对大脑的影响,这些影响可能提供长期益处的提示和可能的意外负面特性(例如,脑容量损失率增加)。事实上,donanemab 的 2 期研究清楚地表明,基于影像学生物标志物发现(高淀粉样蛋白和低至中度 tau)的纳入标准导致了积极的试验结果 (11)。这些生物标志物还有助于指导剂量和治疗持续时间,尤其是在早期临床试验中。
这些抗Aβ免疫疗法的类似益处和风险能否在实际应用中实现?其中许多试验的一个明显弱点是试验受试者缺乏种族多样性。需要共同努力,使用严格的个性化医学方法(即生物标志物)在不同人群中研究这些药物 (12)。在这些试验中对患者进行仔细监测,以及旨在限制潜在副作用风险个体暴露的排除标准,可能有助于限制严重不良事件。由于这些疗法是针对真实世界的人群进行的,因此需要仔细监测以确保严重不良事件的可能性保持在较低水平。鉴于治疗的益处不大,此类事件的大幅增加将引发有关现实世界益处与风险的问题。
治疗可以改善吗?虽然这些免疫疗法不是灵丹妙药,但它们是朝着预防AD或阻止认知能力下降的目标迈出的第一步。必须为AD开发更好的DMT。对于这些或下一代 Aβ 免疫疗法,开发更便宜、更安全、更可扩展和更容易获得的治疗方法将是关键。在美国,aducanumab、lecanemab 和 donanemab 的年费用均为 26,500 美元,但相关的影像学检查和监测意味着一年的治疗费用可能超过 75,000 美元。所有三种单克隆抗体均通过静脉输注给药。因此,一个务实的进步是提高效力,以便免疫疗法可以通过皮下进行或需要更少的输注,这将降低成本,从而增加可及性。
基于组学的纵向探索性生物标志物研究以及对治疗后个体大脑的严格尸检分析可以更清楚地了解治疗益处和风险背后的生物学特征。尽管有一些证据支持,但免疫激活抗体沉积 Aβ 靶标结合导致小胶质细胞清除的概念尚未得到明确证实。从人类那里获得精确的机制数据可以指导免疫疗法的发展,该疗法不会诱导ARIA但仍显示出临床益处。事实上,在详细的病理学和组学水平上,当这些免疫疗法减少淀粉样蛋白时,大脑会发生什么(13),甚至在死后脑组织中进行病理和生化评估时,沉积的Aβ的真实程度仍然未知。
这些积极的数据和对全球推广的需求应该引起对针对 Aβ 沉积物的活性疫苗的重新思考 (4)。AD活性疫苗(AN-1792)的首次试验被停止,因为它导致~6%的参与者出现严重的脑膜脑炎,只有20%的参与者对Aβ表现出强烈的抗体反应。是否有可能产生一种疫苗,该疫苗可以诱导特异性靶向沉积的 Aβ 的强大抗体反应,而不会引起严重的副作用 (7)?目前正在努力开发针对 Aβ 的活性疫苗。尽管目前正在试验中的几种疫苗似乎是安全的,但目前尚不清楚它们是否能有力地诱导抗体的产生,这些抗体可以选择性地靶向沉积的Aβ。无论如何,安全有效的疫苗可以预防性使用,而成本仅为单克隆抗体的一小部分。
更一般地说,这些数据表明需要非淀粉样蛋白靶向DMT和更好的治疗疾病症状。通过改善AD中涉及的其他病理生理过程(如神经原纤维缠结形成、突触丢失、神经炎症、代谢衰竭和细胞死亡)的治疗,可能会获得更实质性的临床益处。即使有一天AD是可以预防的,数百万人也会在那之前出现症状性AD(14)。因此,必须开发干预措施,甚至可能是联合疗法,以更实质性地改变疾病进展。
许多因素导致晚年的认知弹性和认知能力下降,其中一些可能与AD的标志性病理学无关(8,15)。 鉴于这种复杂性,生物标志物引导的个性化医疗方法对于下一代AD疗法以及更广泛的痴呆疗法的发展可能至关重要。希望从AD DMT的先前失败和成功中吸取的经验教训可以务实地应用于简化治疗发现、开发和临床试验。
https://blog.sciencenet.cn/blog-41174-1414305.html
上一篇:氢气临床研究进展【全文】
下一篇:海底热泉好氢气微生物培养方法