博文
线粒体跨细胞转移和线粒体治疗学
|
严肃提出“线粒体医学”或“线粒体治疗学”新概念
线粒体被认为起源于一个古老的内共生过程,在这个过程中,变形菌门被捕获并被吸收用于能量生产和细胞代谢。线粒体在细胞分裂和分化过程中分离,具有线粒体和线粒体DNA基因组从亲本到子细胞的垂直遗传。然而,一些新的文献表明,一些细胞类型输出它们的线粒体,以传递到与发育无关的细胞类型,这一过程被称为细胞间线粒体转移。在这篇综述中,我们描述了线粒体在细胞间转移的机制,并讨论了细胞间线粒体转移如何调节健康和疾病中各种器官系统的生理和功能。特别地,我们讨论了线粒体转移在调节细胞代谢、癌症、免疫系统、维持组织稳态、线粒体质量控制、伤口愈合和脂肪组织功能等方面的作用。我们还强调了靶向细胞间线粒体转移作为治疗人类疾病的治疗策略的潜力。
科学网—低氧能治疗线粒体病! - 孙学军的博文 (sciencenet.cn)
科学网—线粒体移植的替代方案 - 孙学军的博文 (sciencenet.cn)
科学网—真核细胞进化的秘密 - 孙学军的博文 (sciencenet.cn)
科学网—大氧化事件和线粒体的产生 - 孙学军的博文 (sciencenet.cn)
The power and potential of mitochondria transfer | Nature (yyttgd.top)
线粒体是具有多种功能的细胞器,对于几乎所有真核细胞的细胞代谢至关重要。这些细胞器被认为是通过一个古老的细胞内共生过程产生的,在这个过程中,原核生物被选择用于真核生命形式的宿主细胞功能,从酵母到植物到动物。尽管线粒体最常与其在从营养物质中获取能量和产生必需代谢物中的代谢作用相关联,但这些细胞器参与多种过程,包括但不限于细胞信号传导、细胞色素c介导的细胞凋亡的起始、抗病毒免疫反应以及细胞增殖和发育的调节。随着受精后细胞的分裂,母细胞将线粒体贡献给子细胞,这个过程称为线粒体的垂直继承。然后,细胞进行线粒体生物合成以增加和保留线粒体生物量来支持未来的细胞分裂及其细胞功能。人们普遍认为,细胞仅在细胞分裂或线粒体生物合成过程中通过垂直继承获得线粒体,这些过程在其他地方已有综述。
然而,过去二十年的最新研究表明,细胞也可以将其一些线粒体输出并将其传递给受体细胞。这个过程称为细胞间或横向线粒体转移。据我们所知,第一项揭示线粒体转移的功能作用的研究是在2006年报道的,即缺乏线粒体DNA(mtDNA)的ρ0细胞可以通过共培养中来自相邻细胞的线粒体传递而被挽救。过去十年的一系列研究表明,细胞间线粒体转移在体内众多组织中发生,使用各种不同的转移机制,这个过程既有助于正常的生理过程,也有助于疾病的发生发展。
在这篇综述中,我们描述了细胞间线粒体转移的机制。然后,我们讨论了在生理和病理状态下的细胞间线粒体转移的已知功能,以及这一过程如何有助于细胞代谢、癌症、调节免疫反应、维持组织稳态、伤口愈合和其他过程。最后,我们讨论了如何利用细胞间线粒体转移的生物学基础来治疗人类疾病的新兴概念。
几个关键定义
线粒体的垂直遗传:线粒体在细胞分裂过程中传递给子细胞。
线粒体的水平或细胞间转移:线粒体从一种细胞类型传递到另一种细胞类型,而不是通过垂直遗传。
线粒体转移轴:一个定义的起源细胞和一个定义的受体细胞类型建立一个线粒体转移轴。
游离线粒体:从细胞中释放出来,但不被额外的膜结构包裹的线粒体,如细胞外囊泡。
细胞外囊泡相关的线粒体:从细胞中释放出来并包含在细胞外囊泡内的线粒体。
线粒体如何以及为什么被转移,线粒体转移的机制。文献中已经报道了几种不同的细胞间线粒体转移机制,其中一些已经被更详细地探索。这些转移机制可以分为三类:(1)通过形成暂时的细胞连接,线粒体可以从一个细胞移动到另一个细胞,(2)将线粒体排出到细胞外囊泡中,以便传递给接收细胞,和(3)释放游离的线粒体,供接收细胞捕获(图1)。
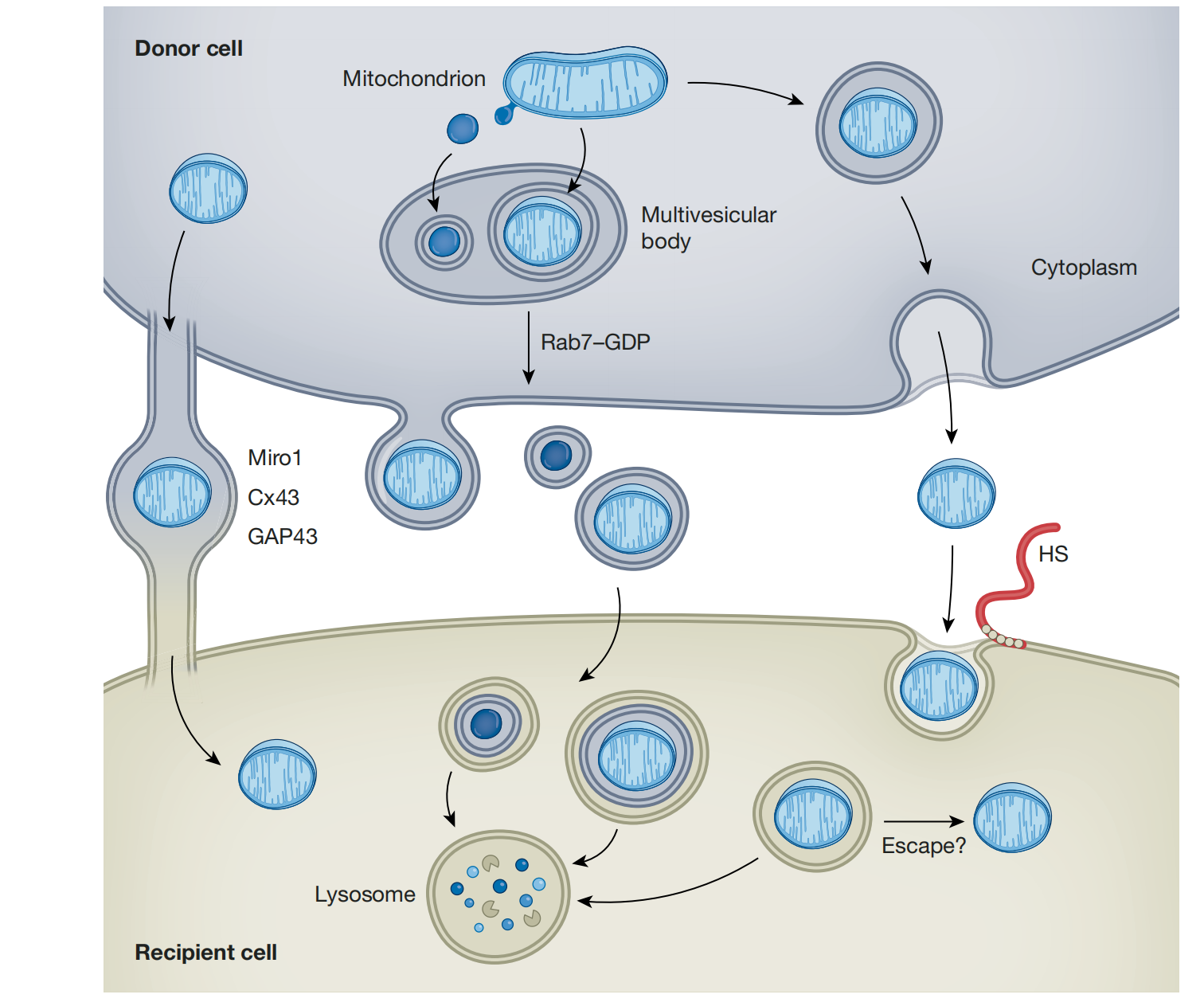
图1:线粒体转移的机制。
细胞通过暂时的细胞连接,如隧道纳米管,来转移线粒体,这依赖于Cx43、GAP43和Rho-GTPase Miro1穿梭。此外,线粒体从细胞中通过多囊泡体输出。线粒体衍生的囊泡和整个线粒体被封装在CD9、CD63、CD81和/或LC3点缀的囊泡中,它们以Rab7–GDP依赖的方式作为细胞外囊泡释放,供接收细胞捕获。线粒体也可以通过从质膜上发芽而作为细胞外囊泡释放。接收细胞通过溶酶体降解捕获在细胞外囊泡中的线粒体。最后,游离的线粒体从细胞中释放出来,然后以肝素硫酸酯(HS)依赖的方式被接收细胞捕获。捕获的线粒体可以通过溶酶体降解,一些证据表明它们可能会逃逸到细胞质中。
暂时的细胞连接 最广泛报道的机制是涉及形成暂时的细胞间连接的过程,这些连接被称为隧道纳米管(TNTs)和/或由Cx43介导的间隙连接通道(GJCs)。一些研究已经表明,某些情况下,像Cx43这样的连接蛋白可能会调节TNTs的形成。这些结构的功能是双向交换胞浆和质膜组分,在参与的细胞之间建立了一种“共生”关系。首次报告这些结构运输线粒体的研究使用了扫描电子显微镜对培养的人间充质干细胞和大鼠心肌细胞进行观察9。自那时以来,TNTs已被报道为心血管系统, 免疫系统,呼吸系统,角膜上皮,肿瘤和中枢神经系统中的细胞间线粒体转移机制,无论是在神经元损伤,还是在神经退行性疾病中。TNTs的形成依赖于生长相关蛋白43(GAP43),可能也依赖于Cx43(参考文献),并且线粒体沿着肌动蛋白–微管高速公路使用Rho-GTPase Miro1进入受体细胞的胞浆。
考虑到TNTs能够共享多种细胞成分,因此确定归因于接触依赖性细胞间线粒体转移的现象是相关的还是直接由细胞之间的线粒体交换引起的仍然是一个挑战。确定细胞使用什么分子机制通过TNTs或GJCs转移线粒体与其他货物相比可能是有用的。这可能允许选择性地破坏线粒体转移,同时允许其他细胞货物被转移。还有一些未解决的问题,例如是供体还是受体细胞通过TNT或GJC要求线粒体转移,或者这是一个涉及两个参与类型细胞的信号的协同过程。
细胞外囊泡相关的线粒体
另一种常见的报道的细胞间线粒体转移机制是释放和捕获含有胞外囊泡的线粒体(EVMs)作为货物。evm可以根据大小和线粒体货物进行分类。直径约100-200nm的小细胞外囊泡通常含有氧化损伤的线粒体成分,正如白色和棕色脂肪细胞释放的EVMs所示。这些细胞外囊泡用四酯蛋白CD63、CD9和CD81标记。在棕色脂肪组织中,经历生热应激的棕色脂肪细胞积累了受损的线粒体成分,然后通过形成线粒体来源的囊泡(MDVs)来去除这些成分。这些结构以pink1依赖的方式形成,并在被排出细胞中可能通过多泡体之前被包装成大约100纳米大小的细胞外囊泡。
然而,这种喷射过程在没有parkin的情况下受损,parkin是一种e3-泛素连接酶,与PINK1结合,标记受损的线粒体成分,通过线粒体吞噬靶向它们降解。因此,PINK1-parkin的相互作用对于线粒体吞噬和mdv的输出都是必不可少的,而且一定有parkin下游的因素决定了使用哪种途径来消除受损的线粒体成分。
与棕色脂肪细胞一样,成骨细胞在细胞外囊泡中释放线粒体,但要通过各种输出机制释放,包括释放线粒体碎片和由线粒体甜甜圈形成的mdv。这一过程是由cd38依赖的过程介导的,并被OPA1所抑制。在这种情况下,释放的EVMs促进骨祖细胞以正反馈回路分化为成骨细胞,从而促进骨形成。由于成骨细胞和骨髓脂肪细胞来源于一个共同的谱系,因此确定线粒体转移是否可能有助于细胞类型的规范将是一件有趣的事情。
心肌细胞也在两种类型的细胞外囊泡中输出受损的线粒体。首先,它们在lc3镶嵌的细胞外囊泡中释放出受损伤的大线粒体,直径为3-4µm。LC3在这些细胞外囊泡上的存在意味着它们来自于自噬溶酶体系统。这些外噬体在心肌细胞自噬受损的情况下优先产生,并被心脏内的巨噬细胞捕获,在那里心肌细胞线粒体被降解。第二,心肌细胞通过多囊泡小体在细胞外囊泡中释放300-600nm大小的线粒体。参与溶酶体融合的小GTPaseRab7,决定了这些EVMs是否从细胞中释放出来。激活的Rab7-GTP有利于细胞内线粒体的溶酶体降解,而失活的Rab7-GDP则导致这些线粒体在细胞外囊泡中的输出。
虽然大多数报告表明细胞外囊泡内的线粒体受损,但情况并非总是如此。一些报告表明,完整的、有功能的线粒体可以从大约1-µm大小的细胞外囊泡中释放出来,这些囊泡也可能通过多泡体从细胞中释放出来或从质膜上脱落。例如,血小板被凝血酶激活后,在细胞外囊泡(以及游离线粒体)中释放具有呼吸能力的线粒体,这一过程似乎是通过质膜出芽机制介导的,而不是多泡体包装。此外,在缺血性中风后的大脑中,星形胶质细胞释放含有线粒体的evm,并传递给缺氧的神经元,以支持神经元的线粒体代谢和存活。CD38介导了这一过程,损害它会导致小鼠更严重的中风病理和更糟糕的预后。
此外,巨噬细胞在背根神经节中释放cd200r点缀的EVMs,通过iSec1传递给神经元,抑制炎症性疼痛信号向大脑的传播。这些研究表明,通过EVMs的线粒体转移并不仅仅是用于维持供体细胞的线粒体质量控制,还可以调节受体细胞的功能。
进一步支持这一观点的是涉及神经干细胞的研究,它在细胞外囊泡中释放完整的功能性线粒体。将这些EVMs放置在mtdna缺失的ρ0细胞上,可以恢复正常的代谢特征,包括逆转它们对尿苷对细胞存活的依赖。神经干细胞来源的evm被内吞,然后整合到骨髓来源的巨噬细胞的线粒体网络中。这一过程阻断了脂多糖刺激后在巨噬细胞中发生的代谢重编程。目前尚不清楚细胞外囊泡中的线粒体如何进入骨髓源性巨噬细胞或ρ0细胞的细胞质。胞外囊泡可能与核内体膜融合,将线粒体内容物释放到受体细胞的细胞质中。需要更多的研究来了解evm与目标细胞对接的机制,它们一旦内化后如何被处理,以及它们在细胞中的定位。
释放和捕获游离线粒体 第三种主要的细胞间线粒体转移机制是释放游离或裸露的线粒体,然后被受体细胞捕获。据我们所知,这种形式的细胞外线粒体最初是在小鼠和人类的血液中发现的,其中一个来源是激活的血小板,它们在激活时释放EVMs和游离线粒体,比例约为2:1。在血液中,缺乏细胞外囊泡的游离线粒体直径约为0.5-1微米,并含有完整长度的mtDNA基因组。小鼠和人类血液中的无细胞线粒体可以用膜电位依赖的线粒体染料TMRE染色,表明血液中的无细胞线粒体是极化的。与这种极化状态一致的是,新鲜的人血浆可以消耗氧气,但在去除线粒体后则不能,这一观察结果得到了一个小组的证实,但另一个小组则未证实。血液中游离线粒体的细胞来源尚未很好地描述,但可能是异质的。血小板是一个来源,脂肪细胞是另一个来源。这些线粒体不在细胞外囊泡中的证据是外线粒体膜蛋白TOM22的表面表达;缺乏CD9、CD63和CD81等细胞外囊泡标志物;以及电子显微镜照片显示无细胞外囊泡膜的游离线粒体。然而,血液循环中可能存在许多线粒体的来源。
细胞以一种依赖于线粒体分裂蛋白(如动力蛋白相关蛋白1(DRP1)和线粒体分裂1蛋白(FIS1))的方式释放游离线粒体。我们缺乏对这些线粒体如何被包装以便输出的详细了解,但起源细胞可能将这些线粒体包含在囊泡中,与质膜融合,将游离线粒体释放到细胞外空间。然后通过吞噬机制捕获游离线粒体,一些人认为这是大吞噬作用。全基因组CRISPR敲除筛选鉴定出受体细胞使用硫酸肝素依赖过程捕获游离线粒体58,这可能反映了细胞间线粒体转移的古老起源。硫酸肝素是复杂的,长度、硫酸化模式、差向异构化、附着核心蛋白和其他特征不同,导致不同的结构和特异性59。硫酸乙酰肝素链在6-O位置的硫酸化对于线粒体捕获至关重要。此外,硫酸乙酰肝素不能介导与游离线粒体大小相似的乳胶珠的捕获。这些观察结果表明,硫酸乙酰肝素的生化特征可以赋予一定程度的特异性,以结合游离线粒体,而不仅仅是由于硫酸乙酰肝素的负电荷,因为缺乏6-O硫酸化的硫酸乙酰肝素仍然保留了其他硫酸基团。用抗凝剂肝素(一种高度硫酸化的硫酸乙酰肝素形式)处理小鼠,足以部分损害线粒体从脂肪细胞转移到巨噬细胞,这表明这种线粒体转移途径在体内是有效的,并且可能受到这种常用抗凝剂的影响。
在被受体细胞捕获后,裸线粒体的命运尚不清楚。一项研究表明,一些裸露的线粒体在被捕获后可以逃离内吞体隔间。这一有争议的观察结果需要进行验证和对其潜在机制的详细理解。然而,有研究表明,细胞可以捕获纯化的线粒体,并利用其在体外和体内进行有氧呼吸。为了实现这种情况,外源性线粒体必须能够在核内体中呼吸或逃逸到受体细胞的细胞质中。由于细菌和病毒可以逃离内溶酶体腔室,线粒体也可能具有这种能力并非不可想象,特别是考虑到它们的变形杆菌祖先起源。如果线粒体逃逸机制确实存在,那么这个过程很可能是由核基因组中的基因介导的。
线粒体转移的功能
最近,我们对细胞间线粒体转移的功能作用的了解有所扩大。虽然一些观察表明,线粒体转移支持受体细胞的能量代谢,但最近的研究表明,这一过程有助于维持各种器官系统的功能。
支持受体细胞代谢
据我们所知,第一个证据表明细胞间线粒体转移支持受体细胞的能量需求是演示ρ0细胞,不能执行氧化磷酸化,因此需要尿苷和丙酮酸生长,可以获得线粒体从共培养细胞体外恢复产生ATP的能力和恢复细胞分裂4。将ρ0细胞暴露于纯化的线粒体中也可以挽救体外的有氧呼吸61。在体外暴露于纯化线粒体的人类乳腺癌细胞中也观察到了类似的结果62。此外,将纯化的野生型线粒体注射给缺乏NDUFS4的小鼠,可以完全恢复腹腔巨噬细胞的线粒体代谢。NDUFS4的小鼠是线粒体复合体I活性所必需的核基因组编码蛋白。虽然野生型和NDUFS4缺陷的细胞捕获外源性线粒体的效率相似,但缺乏NDUFS4的巨噬细胞似乎保留外源性线粒体的时间更长,这表明健康的外源性线粒体可能被选择性地保留在代谢受损的细胞中。
有趣的是,在体内或体外,外源性线粒体似乎对野生型或健康巨噬细胞的线粒体代谢没有显著影响,这表明细胞可能只有在经历代谢危机或超过其代谢能力时才利用外源性线粒体进行有氧呼吸。与这一想法相一致的是,BV2细胞似乎在正常培养条件下不使用纯化的线粒体来促进有氧呼吸,但可以利用它们来克服药物诱导的线粒体衰竭。
这些发现使我们推测,细胞优先利用自身的线粒体进行营养代谢,但如果对代谢紧急情况出现需求,则可以输入和利用无细胞线粒体。我们将这个概念称为“发电机假说”,这反映了许多建筑依靠电网供电,但也可以利用发电机提供的能源来克服电网故障。在这个比喻中,由其他细胞传递的线粒体具有产生能力,直到细胞的线粒体代谢恢复。
一些体内研究也支持这一观点。特别是,缺血神经元和心肌细胞可以接收和使用来自其他细胞类型的线粒体来支持它们的生存。在缺血的大脑中,星形胶质细胞释放EVMs,导致线粒体转移到邻近的神经元(图2a)。用抗cd38单克隆抗体抑制这一过程与缺血性卒中模型小鼠更糟糕的预后相关。另一组研究表明,在缺血性卒中后不久,动脉内给予纯化线粒体会导致梗死区外源性线粒体在梗死区积累,局部恢复三磷酸腺苷浓度,并减少梗死体积。有趣的是,蛛网膜下腔出血后大鼠和人类脑脊液中细胞外线粒体水平也增加,而无膜线粒体的脑脊液膜电位与患者更好的临床预后相关。这些研究表明,无细胞线粒体可能支持缺血性中风和蛛网膜下腔出血中神经元的代谢。
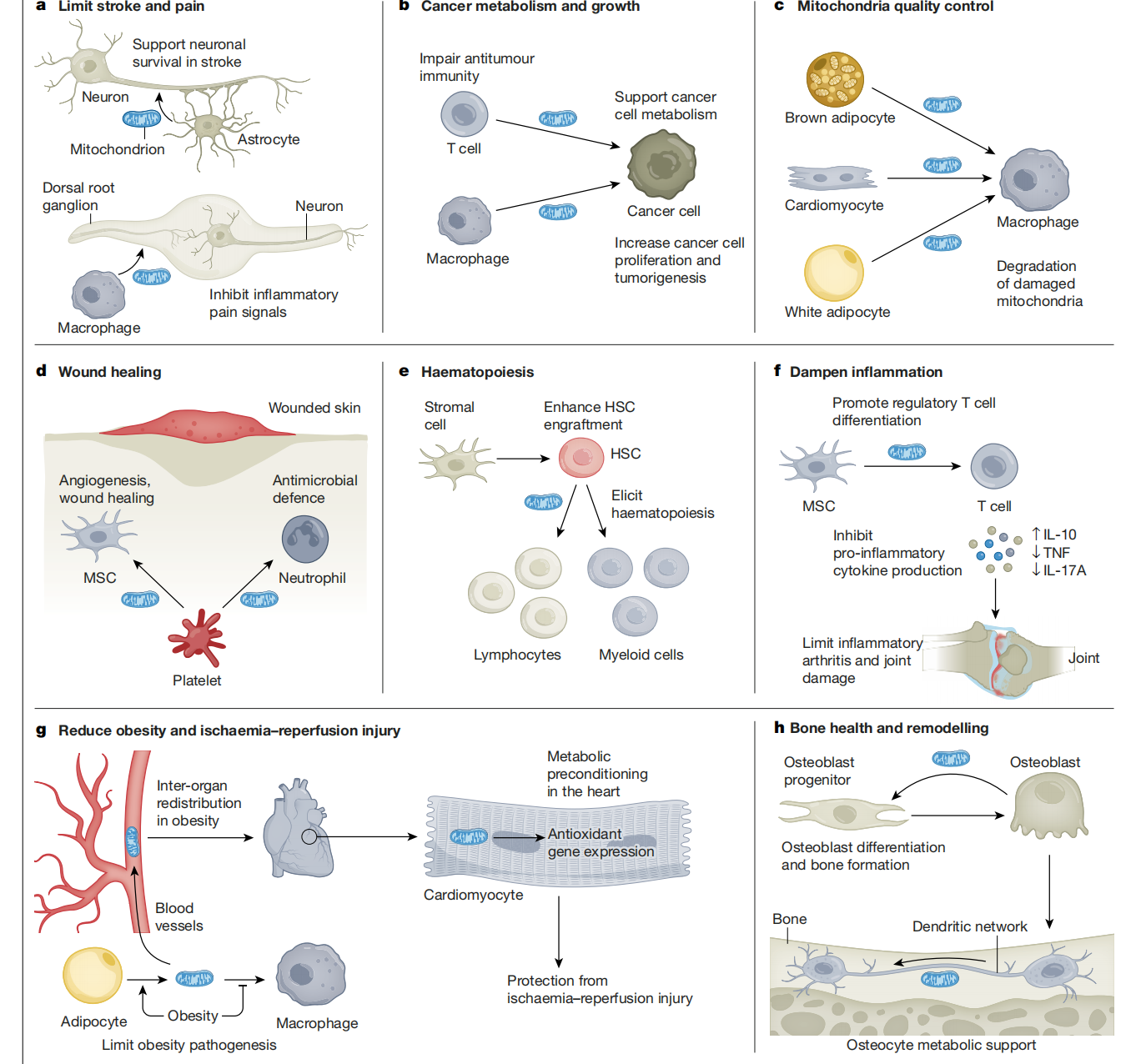
图2:线粒体转移的功能作用。
图2 线粒体以组织特异性和细胞类型特异性的机制在细胞间转移,并与不同组织中的各种生理和病理过程有关。a,在中枢神经系统中,星形胶质细胞向神经元传递线粒体,以支持其在缺血性中风中存活,而在外周神经系统中,巨噬细胞将线粒体传递给背根神经节的神经元,以限制炎性疼痛信号的传播。b,癌细胞从T细胞和巨噬细胞等免疫细胞中获得线粒体,损害抗肿瘤免疫,同时也支持癌细胞的细胞代谢需求,驱动其增殖。c,脂肪细胞和心肌细胞将受损的线粒体转移到巨噬细胞中,以消除和保存供体细胞的线粒体质量。d,在受伤的皮肤中,活化的血小板封闭受损的血管,并将其线粒体传递到间充质干细胞(MSCs),以促进血管生成和伤口愈合,以及向中性粒细胞促进抗菌防御。e,线粒体转移增强了造血干细胞(HSC)的移植物,并有助于诱导造血功能。f,MSCs还将线粒体转移到T细胞,促进调节性T细胞分化,抑制促炎细胞因子的产生,限制关节炎的关节损伤。g,在白色脂肪组织中,脂肪细胞将线粒体转移到巨噬细胞以支持维持组织稳态,肥胖中受损的过程将脂肪细胞线粒体转移到血液器官间运输到心脏,无细胞线粒体引起抗氧化反应,保护心脏免受缺血-再灌注损伤。h,在骨中,成骨细胞将线粒体转移到其祖细胞中,以加强成骨细胞分化和促进骨形成,骨细胞沿着树突状网络转移线粒体,以支持其代谢和骨矿物质稳态
线粒体转移介导的细胞能量需求支持也可以有致病结果,至少在癌症中是这样(图2b)。最初的研究表明,ρ0肿瘤细胞分裂缓慢,但可以通过从邻近细胞获得整个线粒体和相关的mtDNA来获得呼吸功能,从而使细胞分裂更快,恢复其致瘤潜能。外源性线粒体驱动癌细胞增殖的机制尚不清楚,但可能与活性氧的产生有关,活性氧刺激线粒体传递到癌细胞,并导致有丝分裂信号通路的激活,如细胞外信号调节激酶。线粒体转移在癌症中的作用是复杂的,因为据报道这一过程会增加肿瘤细胞的增殖、侵袭性、免疫逃避和治疗耐药性。
已知癌细胞通过tnt和EVMs从其他细胞获得线粒体;然而,转移机制和功能含义可能取决于来源细胞和受体癌细胞类型。事实上,肿瘤细胞可以获得线粒体的不同细胞类型在肿瘤微环境,包括间充质干细胞/基质细胞、癌症相关成纤维细胞、T细胞、巨噬细胞、星形胶质细胞和其他细胞类型,这些不同的线粒体转移轴可能不同影响受体癌细胞。例如,乳腺癌细胞可以从巨噬细胞获得线粒体以促进细胞增殖,从T细胞获得支持癌细胞有氧呼吸和免疫逃避。鉴于在癌症中报道的大量细胞间线粒体转移轴,有必要了解这些不同的线粒体转移轴如何交叉,以调节肿瘤生长和对治疗的耐药性。对这些途径的理解可能会导致新的癌症治疗策略。
供体细胞线粒体质量控制
虽然许多研究表明,细胞间线粒体转移参与支持受体细胞的代谢,但最近的一系列研究表明,这一过程也有助于支持供体细胞的线粒体健康。如上所述,棕色脂肪细胞和心肌细胞在细胞外囊泡中释放受损的线粒体成分,这些成分随后被组织驻留的巨噬细胞捕获和降解(图2c)。损害巨噬细胞对喷射出的线粒体的降解与心脏功能受损和棕色脂肪组织生热有关,这表明这一过程保留了正常的组织功能。来自溶酶体蛋白LAMP2功能缺失突变的小鼠和人类的心肌细胞释放更多的EVMs,这表明当细胞不能通过线粒体吞噬成功地回收受损线粒体时,排出受损线粒体可能是一种代偿机制,以防止受损线粒体积累的代偿机制。Consistent 基于这一想法,最近的一项研究发现,线粒体氧化应激足以促进斑马鱼视网膜中受损的线粒体输出到穆勒胶质细胞,在那里它们被降解。 这些数据表明,不可替代或难以替代的细胞排出受损的线粒体,被巨噬细胞或其他支持细胞清除,作为线粒体质量控制的一种机制,从鱼类到哺乳动物都是保守的。由于一种细胞类型借用了另一种细胞类型的线粒体吞噬功能,我们将这一过程称为“许可的线粒体吞噬”。
调节伤口愈合
在供体和受体细胞的代谢支持外,细胞间线粒体转移途径非常重要的第一个线索之一是这一过程在伤口愈合中的作用。对上皮细胞的物理损伤会导致复杂、复杂的伤口愈合反应,限制出血,抵御微生物入侵,修复屏障表面。当血小板被招募到损伤部位以封闭血管表面时,它们的线粒体从血小板的中心移动到质膜的内表面。当血小板脱颗粒时,其线粒体以evm和游离线粒体的形式被释放在细胞外空间。
据报道,这些血小板来源的线粒体具有独特的互补功能。首次有研究表明,血小板来源的线粒体与中性粒细胞表面结合,驱动抗菌素炎症反应。随后,有研究表明,血小板来源的线粒体也被内皮下间充质干细胞捕获,导致促血管生成因子分泌到血管微环境中,以促进伤口愈合反应。这些发现表明,血小板参与了协调的线粒体转移轴:一个是向中性粒细胞转移,在损伤部位引起局部先天免疫反应,另一个是促进伤口愈合,以恢复破裂的屏障表面(图2d)。
来自血小板以外的细胞类型的线粒体转移也可能有助于伤口愈合。例如,内皮细胞祖细胞可以释放被大脑中成熟的内皮细胞捕获的线粒体,这一过程与血管生成增加和内皮屏障功能增强有关。另一个例子是,间充质干细胞来源的线粒体在体内和体外均可被内皮细胞捕获,增加抗氧化防御系统,减少细胞衰老,减少心肌梗死的严重程度。将人脐静脉内皮细胞体外暴露于间充质干细胞来源的线粒体中,可增加输卵管结构的形成。这些研究表明,细胞间线粒体转移到内皮细胞可以增强血管生成,而血管生成对损伤组织的血管重建是必要的。
对免疫系统的调节 线粒体的一些特征被认为是其细菌祖先的遗迹,包括它们具有低甲基化CpG残基的环状基因组DNA,以及在mtDNA编码的蛋白质中存在甲酰化的N端蛋氨酸肽。未甲基化的CpG残基和甲酰化的n端蛋氨酸肽分别被免疫系统被toll样受体9(TLR9)和甲酰肽受体1-3(FPR1-3)识别为损伤相关分子模式,并驱动促炎免疫反应。由于这些与线粒体相关的损伤相关的分子模式的存在,人们普遍认为无细胞的线粒体本质上是促炎的。然而,据报道,细胞间线粒体转移到免疫细胞具有促炎和抗炎作用。
线粒体转移促炎的最佳例子是中性粒细胞是受体。如上所述,血小板来源的线粒体转移到中性粒细胞会引起一个促炎过程,这可能有助于伤口中异物的清除。同样,在肺移植的情况下,经历排斥反应的同种异体移植物释放线粒体线粒体和/或含有线粒体成分的颗粒到肺泡腔和血液。释放的线粒体成分触发fpr1依赖的中性粒细胞反应,增强对小鼠移植器官的排斥反应。来自肺移植患者的支气管肺泡灌洗液或血液中游离线粒体或mtDNA的丰度与早期排斥反应、同种异体肺移植功能障碍的严重程度以及循环中IL-6、IL-8、IFNγ和IL1-RA的浓度直接相关。
这些数据表明,与组织损伤相关的线粒体释放似乎是促炎的,可能与甲酰化的N端蛋氨酸肽或释放的mtDNA有关;然而,线粒体转移可能以更复杂的方式调节免疫系统的激活状态。例如,在骨髓中,基质细胞来源的线粒体被传递到祖细胞,以诱导白细胞增殖反应,以抵御远处的急性细菌感染20(图2e)。这一观察结果表明,线粒体转移途径可能有助于动员宿主保护性免疫反应。
相反,也有几个例子表明线粒体转移是抗炎的。早期的报道表明,线粒体转移减少了哮喘和急性肺损伤患者中肺上皮细胞的炎症反应。后来的研究报道了适应性免疫系统中细胞间线粒体转移的抗炎作用,特别是当线粒体传递到T细胞时。在移植物抗宿主病和关节炎模型中,线粒体转移优先发生在CD4+ T细胞上,并诱导具有增强IL-10表达和免疫抑制能力的调节性T细胞表型。类似地,线粒体转移传递柠檬酸循环中间代谢物,如天冬氨酸,抑制CD4+ T辅助型1细胞促炎细胞因子的表达,可用于限制类风湿关节炎人源化小鼠模型中的关节损伤。综上所述,这些研究表明,线粒体转移也可以具有抗炎作用(图2f)。 进一步研究的一个令人兴奋的领域是了解细胞间线粒体转移如何在整个正常免疫反应过程中影响免疫细胞的激活、分化和功能,以及这一过程的失调可能如何导致炎症。
维持代谢内稳态
最近的几篇论文表明,细胞间线粒体转移调节局部和系统的代谢稳态,特别是在脂肪组织中。利用骨髓移植和脂肪细胞特异性线粒体报告小鼠,我们发现脂肪细胞在稳定状态(即健康)条件下将线粒体转移到白色脂肪组织中的巨噬细胞58。这一过程部分是由巨噬细胞表面的硫酸肝素介导的,这有助于捕获脂肪细胞来源的线粒体。在饮食诱导的肥胖中,巨噬细胞表现出表面硫酸肝素水平下调,线粒体转移降低,尽管它们的吞噬效率降低。在巨噬细胞中删除Ext1以消融硫酸肝素合成导致体内线粒体转移减少,并与代谢障碍、体重增加和高脂肪饮食诱导的肥胖易感性增加有关。这些研究表明,细胞间线粒体从脂肪细胞转移到巨噬细胞支持正常的能量稳态(图2g),尽管这种作用的潜在机制尚不清楚。
在高脂肪饮食诱导的小鼠肥胖环境下,能量应激的脂肪细胞以至少两种主要形式释放一些线粒体到血液中:含有氧化损伤的线粒体的小囊泡的细胞外囊泡和直径约1µm的大游离线粒体。暴露于棕榈酸或正在进行脂解的脂肪细胞释放出更多的脂肪细胞来源的细胞外囊泡,其中许多含有线粒体蛋白。脂肪细胞来源的线粒体随后被分配到其他器官,如心脏,在那里它们促进抗氧化反应,使心脏能够抵御代谢应激和缺血-再灌注损伤。来自其他器官的线粒体,如骨骼肌,也可以防止心脏缺血-再灌注损伤,改善再灌注后的心室压力,减少心脏损伤的体液证据。从其他器官获得无细胞线粒体对心脏有益的潜在机制尚不明确,但可能涉及心脏中抗氧化酶的诱导。 在代谢不健康肥胖的人类中,血液中的EVMs比代谢正常的对照组更多,这表明这一生物途径也可能在人类肥胖中起作用。
后来,我们证明了膳食长链脂肪酸(LCFAs)直接抑制白色脂肪组织中的巨噬细胞捕获的线粒体,将脂肪细胞来源的线粒体转移到血液中,并输送到心脏。其他模型的肥胖低饮食LCFA暴露,包括老化,玉米淀粉饮食或高脂肪饮食富含中链脂肪酸而不是LCFAs,不表现出改变脂肪细胞到巨噬细胞线粒体转移在白色脂肪组织和没有增加血液中脂肪细胞来源的线粒体。总之,这些研究表明,巨噬细胞感知LCFAs等饮食因素,并确定脂肪细胞来源的线粒体是否被局部捕获以消除或释放到血液中,传递到遥远的器官,在那里它们支持对营养应激的系统代谢适应。
棕色脂肪细胞也可以在细胞外小囊泡中释放线粒体,并将其转移到巨噬细胞。受损的线粒体膜作为mdv被清除,并从细胞外囊泡中的棕色脂肪细胞中排出。巨噬细胞捕获这些棕色脂肪细胞来源的细胞外囊泡并降解它们。消耗巨噬细胞导致棕色脂肪组织细胞外囊泡组织,可以被棕色脂肪细胞或刺激信号通路,下调生热基因的表达,导致棕色脂肪组织功能受损,无法正确保护核心体温在应对寒冷的环境温度。虽然脂肪细胞将其部分线粒体转移到巨噬细胞,以支持维持线粒体质量控制,但它们也在此过程中传递许多代谢物、蛋白质和信号分子,可能影响受体细胞类型的功能。这就提出了一种可能性,即线粒体转移途径可能使细胞能够有效地在局部和远处的器官之间相互传递大量的代谢信息。我们推测,维持正确的线粒体转移轴对组织稳态至关重要,这些转移轴可以局部或系统地改变,以影响器官功能。
除了脂肪组织外,线粒体转移似乎也是维持骨代谢稳态的必要条件(图2h)。成骨细胞将线粒体转移到成骨细胞祖细胞,这一过程刺激其分化成成熟的成骨细胞。这种前馈机制促进了骨基质的形成。此外,被称为矿化骨细胞的特殊骨细胞,通过相互连接的树突状网络相互转移线粒体。供体线粒体支持接收后的骨细胞的代谢需求,从而优化骨矿物质稳态和健康。
线粒体转移疗法
认识到细胞可以从环境中输入线粒体或从其他类型的细胞中获得线粒体,这激发了人们对利用这种生物学用于治疗目的的兴趣。可以认为,第一个临床应用涉及人工强制线粒体转移是卵质移植,早期形式的线粒体替代疗法的细胞质包含线粒体和线粒体DNA从健康供体卵母细胞直接微注射到另一个卵母细胞的致病性线粒体DNA突变。所产生的细胞同时包含供体和受体的mtDNA,用于体外受精。虽然卵浆移植目前尚未得到临床应用,并已被其他形式的线粒体替代疗法所取代,但在接受该手术后出生的儿童中已检测到供体mtDNA90。因此,卵质移植是一个例子,即进入细胞质的外源性线粒体至少可以部分地并入人体体内的线粒体网络。
除了线粒体替代疗法之外,也有相当大的努力来利用线粒体转移的生物学来为患者开发新的疗法。两种很有前途的出生后线粒体移植策略已经出现。一种是在输血给患者之前,在细胞制造或加工过程中将细胞产物暴露在纯化线粒体中。在临床前研究中,这种方法已被用于增强小鼠造血干细胞的移植。随后,进行了一项令人兴奋的临床试验,在大规模造血干细胞移植中,来自mtDNA缺失综合征患者的自体造血干细胞在造血干细胞移植前装载健康的母体来源的线粒体。这种治疗与改善临床特征和生活质量相关。
虽然对于造血干细胞移植的线粒体增强如何改善遗传性线粒体疾病有几种可能的解释,但一种可能是移植的细胞将野生型线粒体传递给受体细胞。另一种原因是,外源性线粒体在给药前在体外代谢地重新连接细胞,这一过程在功能上改变了它们的功能状态。这一想法在工程细胞(例如,嵌合抗原受体T细胞)的时代特别有趣,因为在制造过程中对细胞进行线粒体处理可能会提高细胞产品的性能。
第二种出生后线粒体移植策略是直接给患者使用纯化的线粒体或EVMs。给予外源性线粒体的几种治疗适应症已被探索,包括但不限于预防心脏缺血-再灌注损伤或中枢神经系统。人们对产后线粒体移植治疗遗传性线粒体疾病的治疗潜力有了猜测。虽然外源性线粒体可以挽救来自Leigh综合征模型小鼠的ndufs4缺陷细胞的细胞内在缺陷,但目前还没有直接证据表明线粒体移植可以改善这种疾病。总的来说,这些数据表明,管理无细胞线粒体可能具有作为一种新的亚细胞治疗的潜力。
进一步进行这种治疗的翻译研究应调查有丝分裂核冲突与产后线粒体移植的相关性,实现的mtDNA异质性的程度以及治疗后逆转为致病变异的可能性。此外,重要的是要考虑到线粒体的来源可能会极大地影响线粒体移植治疗的安全性或有效性。
有三条证据表明,人类很可能能相对良好地耐受无细胞的线粒体。首先,一项关于儿科体外膜氧合患者自体线粒体移植的早期临床研究未发现线粒体移植的短期并发症。第二,无细胞线粒体是血液中丰富的正常成分,这表明人类生理学是允许无细胞线粒体的。第三,一些血液制品中游离的和细胞外囊泡相关的线粒体含量很高,特别是储存的血小板,这些血小板经常给没有并发症的患者使用。这些观察结果表明,使用来自自体或异源来源的无细胞线粒体可能很容易耐受;然而,有必要仔细评估新出现的线粒体移植方式的安全性和有效性。
前景 细胞内线粒体转移的工具和技术,以及在健康和病理状态下,细胞内线粒体转移场的发展迅速。许多器官系统、细胞类型和疾病仍有待于通过细胞间线粒体转移生物学的镜头进行研究。虽然已经取得了进展,但我们对已知发生的不同细胞间线粒体转移轴的分子机制仍然知得相对甚少。未来有几个主要问题需要详细研究,包括线粒体转移是否在人类体内发生,以及在什么生理和病理生理背景下;什么信号决定细胞是传递或接受线粒体;每个线粒体转移机制的发生需要哪些基因;以及细胞间线粒体转移如何影响供体细胞和受体细胞的功能。这些问题的答案可能是细胞类型、组织和环境特有的,但有可能从根本上改变我们对线粒体生物学的理解,并可能揭示可用于治疗或诊断目的的生物学途径。
https://blog.sciencenet.cn/blog-41174-1408995.html
上一篇:计算机程序能否模拟大脑?
下一篇:AI读取脑部扫描发现阿尔茨海默氏症基因的希望