博文
肠道气体的生理病理作用
|
这篇综述中,来自南京大学的作者们对肠道气体的生物学作用和肠道气体检测方法等方面研究,给我们进行了比较全面地介绍,作为对气体生物学效应必然有兴趣,特别是氢气医学研究领域的学者,应该重点学习和了解。本文全文机器翻译,虽然进行了全文人工修改,仍然可能存在错误,更准确内容请参考英文原文。
Ignored roles of gases in digestive diseases - ScienceDirect
肠道的复杂性给消化系统疾病的研究带来了巨大的争议和讨论。肠道内气体环境对于塑造动态肠道微环境至关重要,但长期被学术界忽视。许多气体参与肠道厌氧环境中的生物活动,包括氧气、氢气、一氧化碳、氨、甲烷、硫化氢、二氧化碳和氮气。这些气体通过不同的途径参与全身炎症和代谢的调节,从而减轻或促进肠道疾病的发展。肠道气体的构成和变化反映了肠道环境,可用于监测局部代谢的变化,分析消化系统疾病的进展。然而,单个气体在维持健康的肠道微环境或引起消化系统疾病方面具有内在功能,其潜在机制尚不清楚。因此,探索消化道中气体的概况及其对肠道微环境的非凡影响对于理解肠道健康与疾病之间的相互作用具有重要价值意义。通过回顾消化道气体的研究进展,我们预计更好地了解气体的作用将促进该领域的研究和应用转化以及临床疾病的诊断和治疗。
1. 简介
作为最常见的疾病,消化系统疾病影响着人们的日常生活,许多肠道疾病的病理学理论由于其生理环境的复杂性而仍然不清楚。许多研究试图在体外模拟肠道微环境,以研究其生理和病理机制[[1],[2],[3]]。 近年来,对肠内营养、微生物组和肠道环境的深入研究帮助研究人员进一步探索人类健康和疾病发展[4,5]。然而,动态的肠道微环境和对肠道生态系统的有限理解给肠道微环境的繁殖带来了困难[6,7]。理解肠道微环境中最关键的挑战之一是模拟气体成分及其与菌群和肠道细胞的相互作用,这在发展和治疗消化系统疾病方面也起着至关重要的作用。
在肠道中,肠道内产生的气体主要由食物与微生物组的各种反应发酵,受呼吸、食物类型、胃肠蠕动、消化腺分泌和肠道菌群的影响[8]。研究人员一直试图确定肠道发酵中不同物质的命运。许多新兴生物技术正在投资这项研究,包括器官芯片、类器官、3D生物打印、微流体监测等。然而,肠腔的代谢进展仍不清楚[[9],[10],[11]]。该领域讨论和总结气体分析过程的综述和评论很少,这在一定程度上限制了我们对肠道疾病的探索和理解,例如肠易激综合征、过敏和肠道微生物组疾病。甚至还限制了气体递送器新的监管和治疗策略的发展。
因此,有必要总结目前气体在消化道中的进展和应用,并进一步讨论气体在肠道微环境中的作用。本文综述了消化道气体的来源和组成,分析了生理和病理条件下气体的变化,探讨了它们干扰消化系统的潜在机制。我们进一步讨论了目前可用的检测方法及其在胃肠道疾病中的价值。此外,还特别注意对气体生理学的研究,并试图探索它们在诊断和治疗消化系统疾病中的重要性,以促进其转化为实际应用。
2.气体在消化道中的作用
近年来,动态肠道微环境的研究因其在疾病诊断和治疗中的潜在价值而受到广泛关注。尽管分子生物学的最新进展已经取得了有关疾病相关肠道微生物和代谢物不同变异的基础知识,但准确和实时监测这些微生物和代谢物的活性仍然具有挑战性[12]。为了克服这一挑战,肠道中的气体可以提供独特的生物标志物来监测肠道状态,从而可能进一步反映不同的疾病相关状况[13,14]。例如,胃痛和口臭患者经常有幽门螺杆菌感染,这可以通过呼气试验来确认(图1A)。[15]. 临床上,胃酸反流和嗳气常与反流性食管炎和胃溃疡有关[16]。腹胀是肝脏疾病和消化功能障碍最可能的病因,而气体释放增加与肠易激综合征高度相关[17,18]。这些临床经验表明,研究肠道中不同气体的来源和作用对于检查消化系统的诊断和治疗价值至关重要。
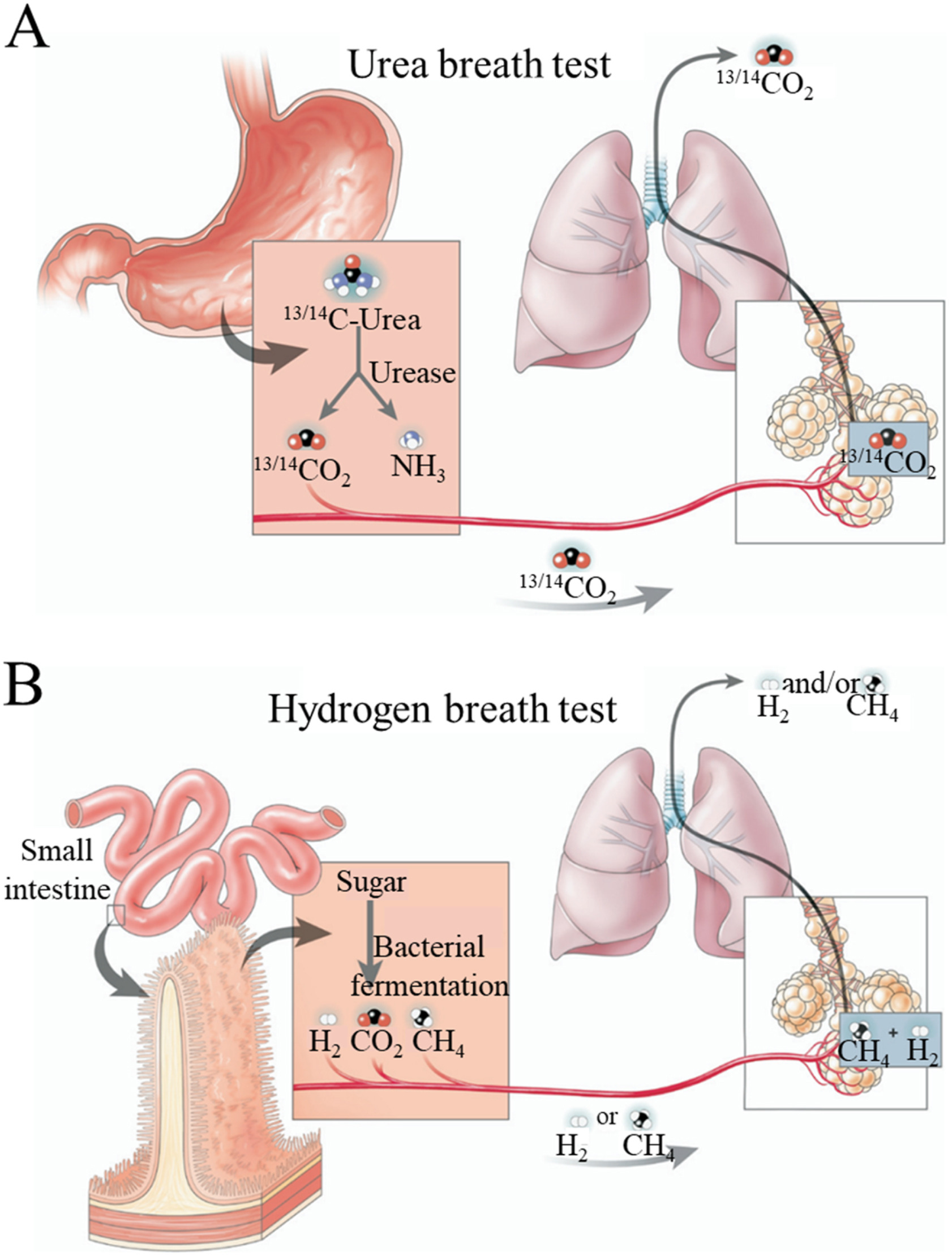
图 1.呼气试验检测幽门螺杆菌感染和肠道细菌过度生长的潜在机制。A) 尿素/碳 13/14 呼气测试示意图。B)用糖进行氢气呼气测试的示意图[19]。
2.1. 肠道内气体的产生
在消化道中,气体由氮(N2(65.1 ± 20.89%), 二氧化碳(CO2)(9.9±1.6%),氢气(H2)(2.9 ± 0.7%),甲烷(CH4)(14.4±3.7%),氧气(O2)(2.3±0.98%)和一些痕量气体,这些气体浓度沿消化道发生变化(图2)[20]。肠道气体可能来自吞咽、内部化学反应和细菌代谢等途径。不同疾病状态下微生物组的异常代谢可导致气体成分的变化,因此可以通过监测动态波动来分析消化道的后续病理状况。
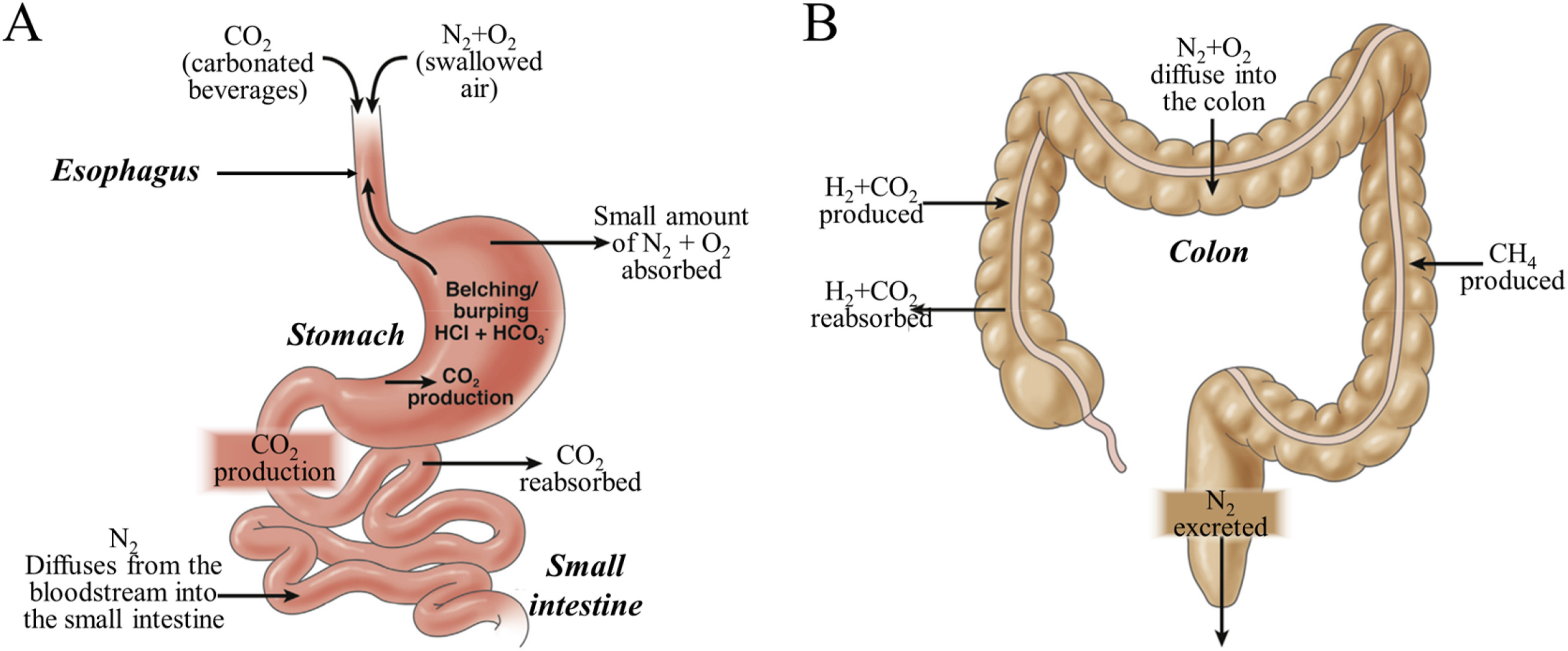
图 2.正常情况下消化道中气体的产生、吸收和排泄[20]。
食物可以作为肠道中的底物,直接影响肠道中的气体成分。服用一些食物后,气体的成分和体积可能会发生显着变化。例如,摄入大豆后肠道气体量增加,肠道内存在大豆低聚糖、棉子糖和葡萄球菌存在下能产生大量的二氧化碳、氢气和甲烷。因此,监测气体构成并分析食物与气体生成之间的相关性,可以为研究肠内营养和肠道微生物组提供参考价值[21]。测定气体变化后,可以进一步分析食物对肠道功能的影响,以预测过敏、炎症和肿瘤等疾病的潜在发展[22,23]。
通常肠道中氧气主要来自吞咽,在肠道微生物特别是需氧细菌的代谢消除过程中逐渐减少。氮气也来自吞咽,肠道内缺乏能代谢氮气的微生物,在整个消化道中保持稳定。氮气相对稳定的化学性质使其难以参与其他生物反应。二氧化碳通常在近端小肠中由胃分泌的碳酸盐和胃酸反应产生。氢气是肠道微生物组代谢过程中的重要产物和食物。肠道微生物组通过发酵碳水化合物产生氢气,然后由产甲烷菌利用,通过与二氧化碳反应产生CH4。在某些条件下,产甲烷菌也会使用氨(NH3) 产生的氢气制造甲烷。氧气、氮气、氢气和甲烷是消化道中的最主要成分,具有反映肠道功能和微生物群变化的实用价值。
还有一些微量气体在维持消化系统平衡方面也起着重要作用。细菌可产生硫化氢(H2S)和含硫的微量气体通过在蛋白质发酵过程中还原硫酸盐和亚硫酸盐,硫化物能调节炎症、运动、分泌和感觉。氨和一氧化碳(CO)属于肠道痕量气体,可分别由脲酶阳性菌株和血红素加氧酶菌株产生[24]。在体内,这三种气体都是典型的双刃剑。氨和CO可以参与尿素等的合成,而过度重吸收存在中毒风险。虽然微量气体只占肠道的一小部分,但它们可以更大地影响消化系统的病理生理学。因此,分析气体的潜在机制有助于进一步了解它们在消化系统中的作用。
2.2. 气体在消化系统中的作用
消化系统疾病的致病机制复杂多样,肠道气体可以有效补充原病的致病理论。一种常见的气体相关胃肠道现象是打嗝,这是横膈膜痉挛从胃中排出气体引起的行为,这与吞咽空气、吃太冷的食物以及精神和肠道的变化有关。焦虑引起的吞气是与呃逆相关的最常见表现。吞咽时气体摄入量增加,其中大部分将通过打嗝排出。这是消化道中外源性气体发病机制的典型例子。外源性气体主要来自吞咽,这在仰卧位尤为明显。在这种情况下,幽门打开气体通过,导致腹胀,嗳气,食欲下降和肛门气体排泄增加。
有趣的是,无论是健康人还是腹胀患者,他们的肠道气体总体积都保持在约200毫升的稳定水平[[25],[26],[27],[28]]。直肠每天大约10-20次通过肛门排泄 500-1500 毫升气体。即使主诉腹胀的患者,其排气量仍然在这个范围内[27]。从肛门排出的气体通常反映了一些消化道内部因素,包括肠道蠕动、肠道微生物群和饮食,这些因素与消化道中气体的产生有关。在健康的胃肠道中,近端小肠产生的气体量最少,而回肠和结肠由于消化道中的多种细菌而显着增加气体含量。肠道微生物组负责肠道内气体的产生,肠道存在明显的个体差异,给科学研究带来挑战。因此,肠道微生物群与气体之间的关系需要在特定背景下进行分析。本文重点介绍气体在疾病诊疗中的价值,而不是微生物群在气体代谢中的作用,因此这部分的具体细节就不赘述了。
阐明胃肠道症状与气体之间的关系对消化系统疾病的诊断和治疗具有重要意义。此外,可以收集和分析这些特征,以建立临床实践数据库。一般来说,与消化道气体相关的最常见症状是气体排泄增加。由于肠道蠕动,气体释放是一种正常现象。当观察到排气过量或臭气时,临床提示患者有不可消化或高度可发酵的食物。测量气体含量和分布有助于了解其在消化系统疾病中的作用。在排泄气体中,氮气、氧气、二氧化碳、氢气和甲烷占99%以上[25]。在内部气体中,它们在消化道中的分布是不同的。例如,N2和 O2在胃中具有较高的浓度,而在肛门排泄气体由较高的甲烷和较低的O2组成。这些主要气体都是无色无味的,而屁是臭的。气味主要来自微量气体,包括含硫化合物、氨气、甲硫醇、二甲硫醚、粪臭素、吲哚和断链脂肪酸[29,30]。这些事实证明,探索气体及其成分变化可以解释消化道中的许多现象。
为了解释体内气体的机理,迫切需要发现分子机制。因此,探索气体如何进入身体并与身体相互作用非常重要。通常,肠道中气体的分压决定了气体扩散的方向。例如,肠腔氢气和甲烷分压远远高于血液,因此氢气和甲烷很容易扩散到组织中,然后通过血液循环运输到肺通过呼吸排泄,也可能被用于新陈代谢。吞咽行为导致胃中氧气分压升高。由于胃内氧气分压比血液中高,氧气很容易通过扩散被直接吸收到胃组织血液中。氧气在结肠分压较低,氧气倾向于从血液扩散到肠腔。同样,N2可在胃中从血液吸收并在十二指肠扩散到血液。与他们不同,CO2由于分压变化,首先在胃中从血液扩散到消化道,在肠道中则被重新吸收[31]。气体的主要成分,即氢气、二氧化碳和甲烷在消化道内处于生产和吸收的动态平衡。例如,来源于上消化道脂肪和蛋白质、肠道发酵底物或酸和碳酸氢盐作用后释放的二氧化碳[32]。大部分二氧化碳在上小肠中产生在到达结肠之前被消化道粘膜吸收。在屁中的二氧化碳可能由结肠中的细菌发酵产生。某些膳食底物,如不易消化的碳水化合物,二氧化碳增加可增加肛门排气[33]。
肠道氢气来自微生物组和人体之间的相互作用。氢气主要在结肠中通过细菌对碳水化合物的发酵产生[34]。富含低聚糖或抗性淀粉的食物不能被小肠中的消化酶有效降解,导致氢气在结肠中产生[35]。氢气除了经过粘膜吸收后呼吸和肛门排气排泄,肠道中细菌也会消耗部分氢气合成乙酸、甲烷和硫化氢等,这些物质参与炎症、代谢等生物活动的调节[36,37]。甲烷合成可消耗氢气。消化道中的史密斯甲白杆菌可以催化氢气和二氧化碳合成甲烷 [[38], [39], [40]]。在消化系统疾病的情况下,患有肠盲环和运输不良(例如硬皮病和假性梗阻)等胃肠道疾病的患者几乎完全不能消化吸收小肠中的碳水化合物,导致氢气在结肠中大量产生。因此,氢气呼气试验可作为检查肠道细菌定植、细菌活性和肠道碳水化合物消化状态的方法,有助于诊断细菌过度生长、消化不良、糖不耐受等(图1B)[[41],[42],[43],[44],[45]]。
除了具有疾病诊断潜力外,氢气在治疗疾病方面也有很大的价值。氢气分子量小,有助于快速穿过生物膜并扩散到靶位点与细胞毒性活性氧发生反应。在动物实验中,氢气可以通过饮用氢饱和水获得[46]。研究表明,氢气能减少细胞中的氧化应激和全身炎症,并已用于治疗疾病,包括败血症、脑损伤、肺部炎症、代谢综合征、心血管疾病、消化系统疾病等[[47],[48],[49],[50],[51]]。 尽管研究表明,氢气潜在的药理和毒理机制尚不清楚。
在临床和实验测试中,氢气已被证明可有效治疗败血症、急性呼吸系统疾病综合征、COVID-19 和心血管疾病等疾病。一些研究提出了基于免疫细胞的思路,这些免疫细胞控制疾病的炎症反应,这扩大了氢在治疗中的机制。氢气医学的典型理论是减少炎症,如可以减少中性粒细胞细胞外陷阱(Nets)的形成和释放。佐野元明等人认为氢气可以非常容易扩散到细胞内,通过电子转移维护线粒体平衡,减少线粒体自由基的产生。此外,Nrf2的转录可以降级以控制氧化应激。在抗炎过程中,氢气可以在许多关键节点上起作用,如抑制NF-κB和Foxp3的表达,导致半胱天冬酶-3磷酸化和凋亡蛋白Bax组装的变化。这些途径共同促进氧化应激的减少和炎症的缓解[52,53]。目前,日本已将氢气作为高级B医疗系统中的治疗,目前医学上已经认识到氢气医疗价值,但也需要强调缺乏足够的证据证明其安全性,以及需要做更多的工作来推进氢的临床转化。
氨气由脲酶合成,可用作肠道细菌的氮源[54]。在传统观点中,NH3由谷氨酰胺与肠上皮细胞的加工和N2的分解代谢产生结肠细菌来源。目前,研究发现肠道微生物群是NH3的主要来源,可通过门静脉进入血液循环[55]。健康的肝脏几乎可以去除所有从门静脉来源的NH3,转化为谷氨酰胺并避免NH3从进入体循环。高水平的NH3会对人体造成损害。当NH3生产过度或肝脏受损,NH3和谷氨酰胺在体循环中会增加。增加的谷氨酰胺会在线粒体中积累,产生谷氨酸和NH3,导致线粒体功能障碍和肝性脑病[56]。作为结论,在肝功能受损的患者中,NH3在肠道中与肝性脑病的风险有关。在临床实践中,乳果糖通常用于降低肠道中的pH值并增加氢离子的浓度。在酸性环境下,可吸收的NH3分子变成不可吸收的铵离子,减少肠道NH3的产生并增加NH3在粪便中的排泄,最终缓解NH3中毒[57]。
除此之外,还有许多其他细菌使用NH3的例子用于生物活性。在幽门螺杆菌感染的情况下,细菌合成NH3通过尿激酶,可以提高生物环境的pH值,同时损害胃粘膜,改变环境以适应自我生存[58]。然而,NH3不仅仅是坏事。也有报道,如果环境中的尿激酶水平降低,导致细菌合成NH3减少,可能引起肠道菌群紊乱和炎症性肠病[59]。因此,肠道NH3 的水平是诊断消化系统疾病的重要线索。
CO由人体血红素加氧酶1产生,可与可溶性鸟苷酸环化酶,细胞色素c氧化酶,离子通道等结合,激活各种信号通路(图3)。肠道微生物群可以通过表达类似于血红素加氧酶的酶来代谢丙酮酸等物质以产生一氧化碳。肠道中的一氧化碳可以通过氧化还原反应,调节菌群的能量代谢和养分吸收。总体而言,低浓度的一氧化碳在体内发挥抗炎作用,主要通过与蛋白质中的低价过渡金属中心协调以表现出其生物学作用[60]。该过程涉及控制细胞内信号和离子通道的基本信号通路。因此,一氧化碳在抗炎、心脏保护、抗癌和抗凋亡应用中具有巨大潜力[[61],[62],[63],[64],[65]]。有趣的是,消化道上皮的高渗透性允许快速气体吸收,使气体信使能够肠内应用。为此,Giovanni Traverso等人将CO封装在泡沫水凝胶中以在消化道中缓慢释放气体,这可能在对乙酰氨基酚诱导的小叶中心充血,肝细胞变性和凝血性坏死中表现出保护作用。此外,在减少结肠炎的隐窝损伤、水肿和多形核中性粒细胞浸润方面也显示出积极的结果[66]。这些结果为输送治疗性气体治疗急性和慢性炎症性疾病提供了新思路。
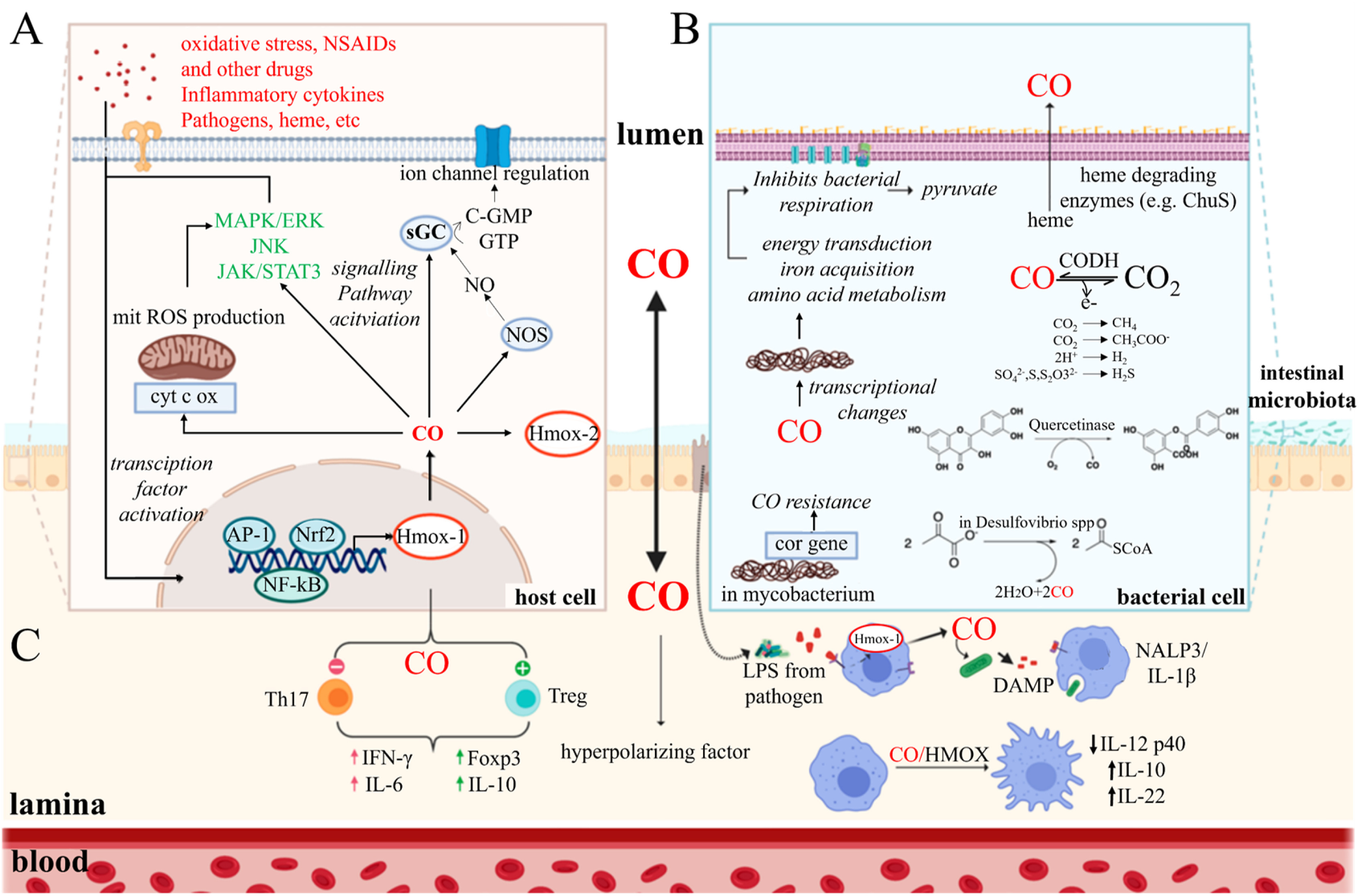
图 3.一氧化碳在连接宿主和肠道微生物群方面起着重要作用。
气体不仅可以与身体相互作用,诱发各种生物效应,而且身体还可以以各种方式调节气体的产生。廖新迪等发现,宿主miRNA,即盲肠内容物中的gga-miR-222a,可以选择靶向微生物群中的两个蛋氨酸合酶基因,ODOSP_3416和BF9343_2953,以控制H2S的产生。蛋氨酸浓度升高,H2S 降低浓度表明宿主控制消化道气体的潜力。它说明了气体和人体的相互作用。胃肠道中的气体产生也可能受到药物的影响,并且可以检测到这些变化以反映药物的疗效或相关的副作用。例如,菊粉是一种膳食纤维,通常用于改善临床实践中的肠道蠕动。然而,肠道敏感的患者在给予少量菊粉后可出现腹胀、腹泻和肠音亢进。通过检测 H2 通过呼气测试和体外发酵模型构建,Robin C Spiller等人发现添加车前子可以显着减轻副作用[68]。这表明监测和分析气体对于维持肠道健康的重要性。
CH4 是消化道气体的另一个主要成分,其产生和变化揭示了几种疾病的发展,包括结直肠癌、憩室病、炎症性肠病和肠易激综合征(图4)[69]。肠道中的产甲烷菌可以利用H2减少二氧化碳、甲醇或乙酸盐生成 CH4 [70]在大多数情况下,产甲烷菌,主要是史密斯甲烷菌,使用H2和二氧化碳作为生产甲烷的基材 [71]。先前观点认为,哺乳动物细胞既不能产生也不能利用CH4。因此,CH4 的变化可以揭示肠道微生物组的动态条件和疾病状态的功能障碍。最近的研究表明,所有生物体都会释放CH4,特别是当细胞中形成活性氧时,CH4可由芬顿反应产生。因此,CH4 含量的变化可以反映体内氧化应激的水平[72]。就CH4而言排泄,约占CH4的80%来源于微生物的微生物将通过肛门排泄,其余的则通过呼吸排出[73]。动物模型和临床实验都表明,CH4可影响胃肠道神经和肌肉功能。呼气试验检测CH4的量与肠蠕动成正比,肠蠕动可能与肠道功能和疾病密切相关[69]。尽管目前许多想法表明CH4与结肠癌、肠易激综合征、炎症性肠病和肠憩室密切相关,很少有研究能够阐明所涉及的机制。一个被广泛接受的想法是CH4改变肠道蠕动,从而调节粪便在体内的滞留,并影响肠道炎症的激活以改变肠道健康[73,74]。然而,需要进一步研究细节以阐明所涉及的分子机制。
图 4.气体在功能性胃肠道疾病中的潜在机制。
氧气浓度是调节肠道功能的重要生物标志物。在大多数情况下,从口腔摄入的气体被吸收以维持肠道中的缺氧状态并产生O2 浓度梯度,对肠粘膜细胞吸收营养、肠道屏障功能以及先天性和适应性免疫很重要(图5)。人体吸入氧气的分压保持在约145mmHg。当这些气体进入小肠并被肠道血管和淋巴管吸收时,O2在小肠中的水平一般小于10mmHg,在粘膜侧O2分压从绒毛的22 mmHg迅速增加到隐窝中的59 mmHg。而且,随着管腔的进展,O2的浓度在管腔逐渐减少。有趣的是,整个结肠的O2分压低于小肠,包括黏膜侧(图5A),这可能是因为小肠对消化和营养吸收的贡献[75]。另一种可能性是微生物群和细胞都调节O2肠道内。出生时的人体肠道由厌氧菌和需氧菌组成。O2吸收和消耗随着肠道的生长而增加,厌氧菌在3岁以后逐渐占据主流地位[[76],[77],[78]]。 宿主还通过控制 O2 来调节肠道微生物种群大肠水平。如果采取干预措施,例如抗生素治疗,微生物群代谢物的含量会随着SCFAs的减少和O2的增加而受到干扰。

图 5.肠道氧气水平和相关代谢调节。
事实上,O2可以通过多种途径调节肠道稳态,其中最典型的途径是缺氧诱导因子(HIF)途径[81]。HIF通过感应O2来调节一系列肠道功能在消化道中。肠道微生物组增加 O2通过产生SCFAs等代谢物消耗肠上皮细胞并维持肠道的缺氧环境。之后,肠道中的缺氧微环境诱导HIF的表达,维持肠上皮细胞的新陈代谢,屏障功能和存活。它还促进粘液和抗菌肽的产生,从而调节微生物组。此外,SCFAs激活mTOR-HIF途径,从而增加IL-22的产生。它有助于组织和器官的增殖、重塑和修复[82]。相反,HIF信号的过度激活可能导致结直肠癌[83]。多种气体,如 硫化氢和一氧化碳可促进HIF信号通路的激活。信号通路的激活也会引起细胞内O2的变化内容,形成反馈,但具体机制尚未报道。目前,给定可能的HIF信号通路由肠道O2调节,已经开发出几种治疗性药物来治疗贫血、炎症性肠病等[84,85]。进一步探索气体在肠道中的作用,在开发新的肠道疾病诊断和治疗策略方面具有巨大潜力。
H2S在微量气体参与消化系统疾病的发展中起重要作用,特别是在免疫力方面。内源性H2S来自肠道中的酶催化和酶非依赖性催化途径。肠道酶,即胱硫硫氨酸-β-合酶和胱硫硫氨酸-γ-裂解酶,可以催化l-半胱氨酸转化为内源性H2S.此外,硫酸盐还原细菌可以利用含硫的氨基酸和硫酸盐生成H2S与酶无关[87]。在炎症性肠病中,结肠衍生的内源性 H2S可以通过抗氧化和抑制中性粒细胞聚集来对抗炎症并促进溃疡愈合,显示出粘膜保护作用。在动物实验中,抑制内源性H2S导致明显的肠道炎症和黏膜损伤,而施用外源性H2S可降低TNF-α的表达,缓解结肠炎症[88,89]。然而,H2S的毒性作用可以在结肠癌患者中发现。 流行病学研究表明,西方高脂肪高蛋白饮食中富含硫化物,会促进过量H2S,增加结直肠癌的发病率[93]。H2S参与肠道分泌、胃肠蠕动和内脏伤害感受的调节,促进胃肠黏膜损伤的修复。它还参与炎症反应、细胞增殖和基因突变,这与IBD、结直肠癌等有关。是否 H2S在胃肠道疾病中起的保护或破坏作用尚无定论,其对胃肠道疾病的作用机制仍有待进一步研究。
2.3. 检测消化道中的气体
尽管气体在消化系统疾病中起着至关重要的作用,但缺乏对潜在机制的充分了解极大地限制了其在诊断和治疗肠道疾病的应用。对气体动态活动的检测和进一步分析将加速对肠道微环境的识别。检测方法可分为三大类,即体外消化模拟器、间接测量和直接测量方法。体外消化模拟器是通过模拟肠道微生物生态系统对气体产生和成分进行体外分析的模型。微生物可以从粪便中获得或通过培养实验菌株制备,产生的气体可以通过气相色谱法进行分析。通过这种方式,可以进一步分析肠道微生物与其代谢(例如气体)之间的关系,包括发酵的时间,代谢物之间的相关性,微生物群和气体谱,微生物群的行为以及饮食对肠道的影响[[90],[91],[92]]。然而,这种检测方法不能收集人体调节肠道微环境的反馈[94]。
间接测量方法的关键是将人体保持在封闭的环境中,收集和分析呼出的气体和放屁。由于代谢不同食物后产生的气体具有多样性,因此该方法也可用于评估饮食摄入量和身体新陈代谢。经典方法之一是呼气测试。气体可以通过肺循环排出体外,肺循环可以收集和分析。一个具体的例子是碳十三呼气测试;可检测到幽门螺杆菌感染患者C13二氧化碳饮用同位素标记的尿素后。间接测量可以简单地解决一些复杂的问题;但是,这种方法只能检测废气,难以收集以进行定性分析。
直接法从肠道收集气体进行检测,临床精度高。然而,直接插管收集的依从性很差。气体的直接检测通常使用可摄入的装置,例如可摄入的气敏胶囊,它不仅可以监测气体浓度,还可以确定肠道中气体产生的位置。Kourosh Kalantar-Zadeh等人开发了一种具有导热性和用于检测气体的半导体传感器的可摄入电子胶囊。胶囊可以检测到O2, H2和二氧化碳 通过校准传感器的热元件来调整选择性和灵敏度。在特定的应用中,他们分析了肠道中微生物组的丰度和纤维的发酵(图6)[95]。可摄入胶囊的优点是实时监测消化道中的气体分布,具有高精度和良好的依从性。然而,在胶囊内窥镜检查的情况下,有可能将胶囊监禁在肠道中,并伴有结构异常,例如憩室和狭窄。而且,患者需要提前使用泻药排空肠道,这也会影响气体代谢。

图 6.一种可摄入的胶囊,用于监测消化道中的气体。A)(i)气敏胶囊的内部结构图。(ii) 肠道气体将透气膜渗透到传感元件上。B)胶囊内部气体传感器的基本电路图。C)来自同一志愿者的气体曲线最初采用低纤维饮食,然后转为高纤维饮食[95]。
3. 结论
消化道中气体的研究提供了一种监测复杂内部微环境的新方法。对气体的组成和功能进行综合分析,有助于了解体内食物和药物的代谢情况,确定药物、过敏、耐药性的个体差异。目前,研究已经证实了食物对消化道气体的生物学作用,如增加膳食纤维摄入量,上调肠道发酵,促进气体产生。然而,由于目前体内分析的局限性,对气体生产的具体过程和机制知之甚少。新兴的检测工具可以直接检测肠腔内气体的分布,规划气体图谱并建立数据库,促进气体药物在消化系统疾病中的机理和使用研究。通过监测气体信号,可以评估饮食质量,检查胃肠道疾病的表现,成为实时监测和定位疾病的有效方法。气体也可用作内窥镜检查的诊断因素,以支持胃肠道段以进行更好的观察。本综述表明,这种操作可能会干扰胃肠道稳态。通过阐明消化道中气体的价值,可以通过内窥镜以非侵入性方式输送气体进行治疗。随着检测技术和定位方法的改进,气体可以成为科学和临床研究促进疾病诊断和治疗的有力助手。
https://blog.sciencenet.cn/blog-41174-1401411.html
上一篇:抗氧化剂促进癌症发生的分子基础
下一篇:听力障碍老年人更容易痴呆,助听器能预防