博文
用干细胞治疗疾病的再生医学
|
几乎所有人类疾病,无论是损伤、感染、慢性病还是退行性疾病,都会损害组织(1)。此外,45%的死亡可归因于炎症和纤维化相关的再生失败(1)。在损伤后恢复健康需要回答一个关键问题:如何诱导人体组织再生?确定指导难治性组织沿着再生路径前进的指导性线索仍然是一个关键但难以捉摸的目标。尽管如此,针对阻碍再生的障碍的方法,包括祖细胞不足和/或功能不足、纤维化和慢性炎症,正在继续从基础到床边发展。使用细胞疗法、体内重编程、合成生物学以及抗纤维化和抗炎疗法克服这些障碍已经取得了关键进展,但仍然存在许多挑战,必须解决知识差距,以使再生成为现代医学的支柱(1)。
Emerging frontiers in regenerative medicine | Science
再生疗法最显着的要求是替换因疾病而丢失或受损的组织成分。激活内源性干细胞是一种有吸引力的策略,但迄今为止,最大的益处已经来自细胞疗法。基于成体干细胞的再生疗法已被证明对治疗血液系统恶性肿瘤、烧伤创面和眼部变性具有临床益处。这些治疗方式也有助于基因编辑以纠正单基因扰动。例如,一名患有交界性大疱性表皮松解症(一种由层粘连蛋白-332基因突变引起的致命皮肤病)的小男孩接受了自体(患者自己的)皮肤移植治疗(2)。收集男孩皮肤的毫米大小样本,并用表达野生型层粘连蛋白332 cDNA的逆转录病毒载体进行转导;然后将组织在体外扩增,然后移植以恢复80%的体表面积。
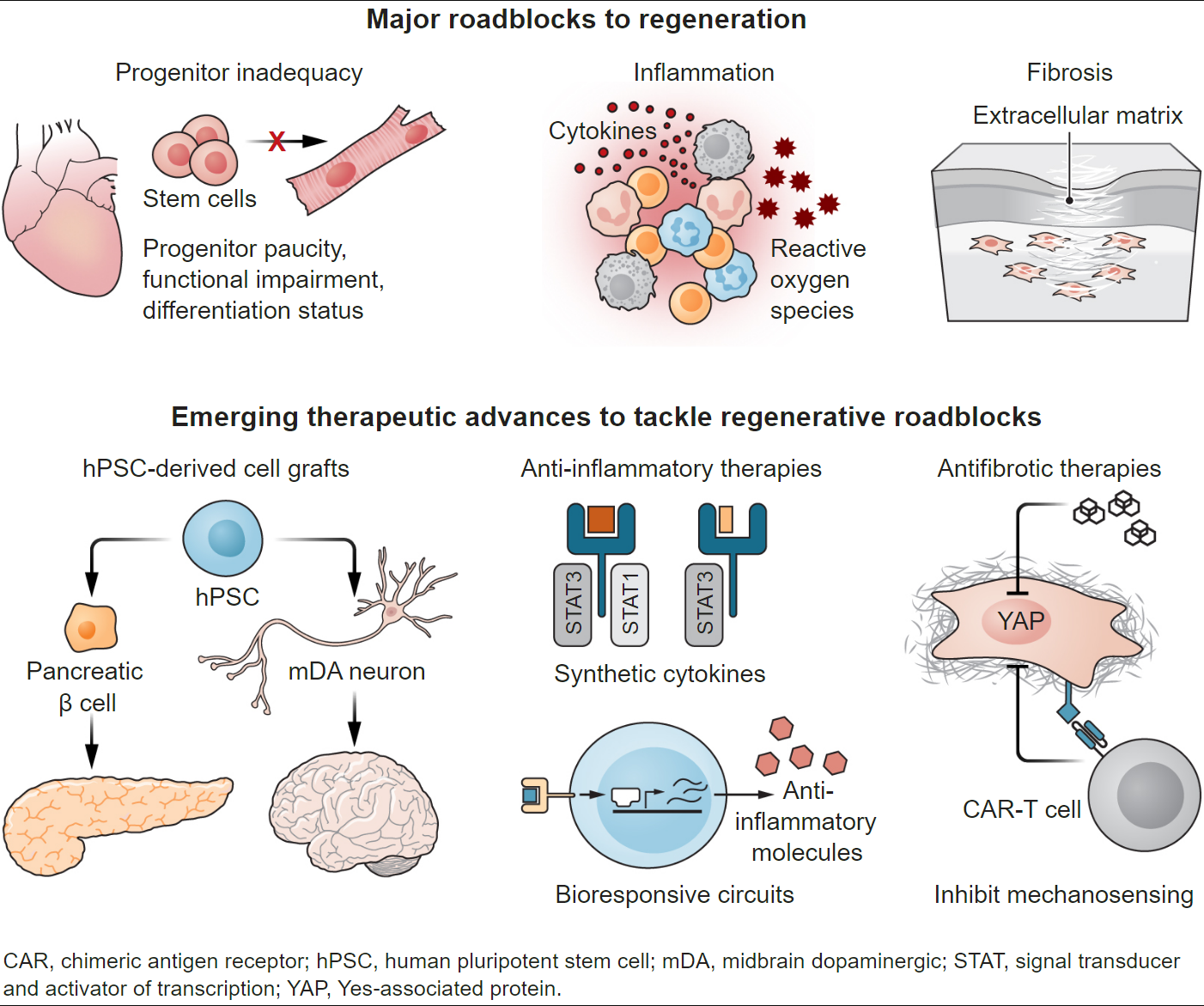
基于人类多能干细胞(hPSC)的疗法也显示出前景,并已在美国进入临床试验,用于1型糖尿病(T1D;NCT04786262),帕金森病(PD;NCT02452723和NCT03119636)和年龄相关性黄斑变性(AMD;NCT04339764) (3).这三种疾病特别适合基于干细胞的疗法,因为它们与特定细胞类型的缺乏有关:T1D中产生胰岛素的胰岛,PD中的中脑多巴胺能(mDA)神经元和AMD中的视网膜色素上皮细胞。此外,移植部位可以通过手术进入。正在评估实验室产生的hPSC在减轻疾病症状方面的安全性和有效性。一名接受自体hPSC衍生mDA神经元中脑移植的PD患者的病例报告显示移植稳定,无免疫反应,植入后2年表现出运动功能改善(4)。
尽管有这些早期的成功,但细胞疗法受到许多生物学和技术障碍的阻碍。源自诱导多能干细胞(iPSC)的基于自体hPSC的疗法可避免免疫恶化,但这种成本和劳动密集型策略需要对每次使用进行安全性测试。非自体细胞治疗的一个主要问题是移植物的免疫排斥反应。因此,“现成的”同种异体疗法必须与允许它们避免排斥的策略相结合,例如T1D hPSC治疗中的全身免疫抑制(NCT04786262)。另一种策略是将移植物封装在选择性渗透屏障内,以允许营养物质和治疗分子(例如胰岛素)的扩散,同时排除会排斥移植细胞的免疫成分。为了避免纤维化异物反应,最近的化学修饰藻酸盐包封策略在非人灵长类动物模型中显示出希望。然而,一项使用类似方法递送表达因子VIII的细胞用于治疗血友病A(NCT1)的04541628期临床试验在患者经历严重不良免疫事件后停止,随后,植入的胶囊被发现纤维化。尽管如此,封装策略在其他情况下正在向前发展,包括最近美国食品和药物管理局(FDA)批准对封装干细胞来源的胰岛进行人体试验(NCT05791201)。此外,正在进行的工作正在研究减少免疫排斥的其他策略,包括移植细胞的基因工程以逃避免疫识别或分泌诱导局部免疫耐受的免疫调节细胞因子。
推动再生医学进步的治疗前沿
再生的三个主要障碍是祖细胞功能不足、慢性炎症和纤维化。正在进行的临床试验正在测试hPSC衍生的β细胞和mDA神经元分别治疗1型糖尿病和帕金森病的功效。正在开发合成细胞因子和生物反应系统来限制炎症。抑制成纤维细胞和成纤维细胞抗原特异性CAR-T细胞中的机械传感途径正被用于限制纤维化。
在皮肤中产生足够数量的细胞用于植入已经成功(2),但对其他器官的再生组织构成了重大挑战,特别是如果移植后只有一小部分细胞存活。例如,hPSC衍生的mDA神经元的存活率为∼0.5%至10%,并且正在努力确定移植物丢失的潜在机制。此外,当需要复杂的细胞混合物时,例如在肺中实现气体交换,产生适当的移植物仍然是一个挑战。利用组织自组装和类器官形成转移复杂组织单位的临床前研究正在进行中。
组织过度生长是干细胞疗法的主要关注点,因为转移的细胞可引起畸胎瘤或其他肿瘤。生长停止信号,特别是在细胞疗法的情况下,尚未得到很好的理解,在部署再生疗法时,分子“关闭开关”对于整合至关重要。长期以来,河马信号通路被认为是器官大小的主要发育调节因子,因为该通路中的失活突变会产生过度生长表型。然而,最近的研究表明,河马途径激活不是参与正常的发育计划,而是诱导黑腹果蝇异常生长途径的异位表达(5)。发育途径是否重新参与重建成人组织或成人再生需要一组不同的调节因子,正如河马信号传导研究所表明的那样,尚不清楚。因此,有必要在适合年龄和器官特异性的模型中仔细定义微环境和细胞内在生长限制信号,以抑制移植细胞的生长。
指导性的微环境信号通常是最佳细胞功能所必需的。因此,可以通过静脉注射的干细胞疗法的成功取决于迁移到适当的组织生态位中。细胞或组织移植物也必须与宿主的神经和血管机器连接,所涉及的信号仍然知之甚少(6)。克服在难以到达的内部器官中引导和整合移植物的挑战的另一种方法是通过使用特定的转录因子原位重新编程来重新利用损伤部位存在的细胞 (6)。对于成人心脏来说,重编程是一种特别有吸引力的策略,与胚胎心脏不同,成人心脏缺乏真正的祖细胞。体内细胞重编程工作的一个子集旨在将成纤维细胞转化为心肌细胞以维持心脏功能(6)。或者,成年心肌细胞中多能转录因子的瞬时表达诱导增殖,从而改善成年小鼠心肌梗死后的结局(7)。然而,这些因素的长时间表达产生了肿瘤。为了克服这一重大的安全挑战,正在努力使用在高度再生斑马鱼模型中首次发现的增强子元件仅在损伤条件下表达重编程因子(8)。了解哪些细胞被重新编程,它们是否以及如何存活,它们变成什么,以及它们如何准确地促进临床结果对于预测治疗效果至关重要。
除了用细胞疗法和体内重编程替换丢失的组织外,许多有害和复杂的疾病状态还会引起炎症反应,这些反应也必须被抑制(见图)。患病的受体组织的状态,仍然是应用细胞疗法的一个具有挑战性的方面。细胞或组织可能无法在不适宜居住的环境中移植,或者破坏原始组织的潜在病理也可能损害移植物(9)。例如,炎症性肠病 (IBD) 是由异常免疫反应、上皮修复缺陷、正常肠道微生物群落丧失以及细菌易位到下层组织驱动的。尽管向IBD患者的受损肠道提供肠上皮细胞可以作为临时贴片,而不会减轻炎症或易位微生物,但这些方法在实现长期疗效方面面临重大障碍。
调节炎症的新方法包括用生物响应基因回路改造干细胞,这些基因回路可以感知炎症因子,如细胞因子或活性氧,进而诱导抗炎因子的产生,允许内源性祖细胞或移植细胞修复损伤(9)。事实上,一些干细胞疗法的有益效果已被追溯到移植的免疫调节作用,而不是干细胞本身的组织生成特性。在心脏缺血性损伤的小鼠模型中,移植干细胞增强心脏功能,不是通过产生心肌细胞,而是通过激活巨噬细胞来限制细胞外基质(ECM)沉积并调节受伤区域的机械性能以使心脏恢复活力(10)。
调节免疫系统是一项艰巨的挑战,因为相同的因素可以通过炎症作用促进修复或造成损害(11)。例如,在损伤早期,白细胞介素-17 (IL-17) 能够适应受损上皮的缺氧,但持续的 IL-17 信号通过募集引起损伤的中性粒细胞来增强病理学 (11)。合成生物学提供了将炎症的损害性影响与参与修复的影响分开的机会。IL-22诱导再生信号换能器和转录3激活剂(STAT3)和促炎STAT1转录因子的表达。在放射性损伤小鼠模型中,将IL-22与受体结合改变,仅诱导再生STAT3促进肠道干细胞增殖,而不驱动STAT1介导的炎症结果(11)。
再生的一个关键障碍是纤维化,它通过随意沉积ECM来迅速堵塞受损组织。纤维化深刻地损害组织力学和细胞相互作用,并物理阻碍器官功能(1,12)。众所周知,抗疤痕疗法很难实现,因为转化生长因子-×(TGF×)等促纤维化因子在维持健康方面也具有重要作用。或者,通过抑制成纤维细胞Yes相关蛋白(YAP)(一种机械感觉转录协同调节因子)来调节机械信号传导,可防止小鼠皮肤修复过程中的疤痕形成(12)。值得注意的是,以这种方式对抗纤维化足以恢复皮肤的结构和抗拉强度。同样,使用工程嵌合抗原受体(CAR)T细胞靶向ECM生成的心脏成纤维细胞上的保守抗原可减少缺血性损伤后的纤维化并恢复心脏功能(13)。这些研究表明,成人器官可能仍然具有激活再生反应的分子路线图。对再生驯鹿鹿角皮肤和背部瘢痕皮肤的成纤维细胞的比较发现,炎症启动区分了促纤维化状态(14)。因此,精确针对炎症还可以改善纤维化并释放潜在的再生能力(1)。
曾经被认为是医学未来的现在正在成为现实。但是(目前)还没有再生的神奇药丸。除了科技创新,还有成本和生产的实际考虑。由于缺乏适当的临床前模型和缺乏关于构建组织的指导性信号的基本信息,再生疗法的创新受到阻碍,涉及多种细胞类型的复杂疾病或损伤。因此,目前正在努力系统地绘制组织修复随时间,不同模型系统和不同类型损伤后(14)。非脊椎动物物种甚至植物王国的激进策略并没有将疗法限制在哺乳动物生理学的规则上,而是浮出水面。例如,增强软骨细胞合成代谢的纳米级植物光合作用系统可以限制小鼠的软骨降解和骨关节炎(15)。最后,实现人类再生将需要从啮齿动物模型快速过渡到临床相关的大型动物和人类研究。登上人类再生的顶峰需要跨学科的努力,将生物学家、生物医学工程师和临床医生聚集在一起。从顶部看,将揭示一个转变的医疗景观,能够无缝地恢复器官的活力,最终延长人类的寿命和健康寿命。
https://blog.sciencenet.cn/blog-41174-1389434.html
上一篇:[转载]氧气剥夺延长寿命?
下一篇:慢性肠炎多是心病,心病需要心治!《细胞》