博文
结的巢穴 |《自然-合成》一月刊
||
微信:点击阅读微信原文
点击期刊封面,了解更多详情
结的巢穴
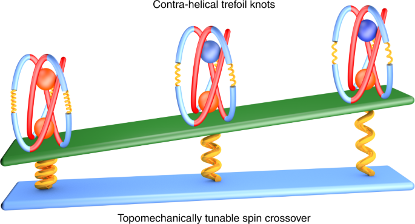
研究人员将一个小的多股螺旋同轴嵌套到更大的反螺旋内,合成了以二价铁为模板的反螺旋三叶结。该方法实现了4种以二价铁为模板的三叶结的近定量一步合成。这些三叶结的自旋交叉性质可通过改变分子内张力进行调控。
1.数步子 | Counting steps
将步数作为合成效率的衡量指标同时带来了机遇和挑战。在本文中,我们建议将合成步骤的构成和步数计量方式标准化。这些建议或有利于对已发表的合成路线进行整体评价。
在影片《星际穿越》中,工程师和宇航员Cooper与他儿子Tom所在学校的校长有过一次不太愉快的谈话。校长告诉Cooper,根据标准化考试的成绩,Tom没有资格升入大学:
校长:Tom的分数不够上大学。
Cooper:(稍作停顿)你腰围多少?32英寸?内缝33?
校长:我没太明白你的意思。
Cooper:量你的屁股还需要两组数字呢,而一次成绩就决定了我儿子的未来吗?
读者们在阅读合成领域的文献时,可能会有与Cooper类似的感受——仅用步数这一个指标来评价合成路线?作为科学家的我们看重硬数据。为推动合成科学的发展,有必要了解我们需要什么数据,以及哪些地方需要改进。将原材料A转化为目标产物B需要多少步?在回答这个问题之前,需要考虑两个相关而又截然不同的问题:首先,化学步骤由什么构成?其次,哪些时候用步数来衡量合成质量?
2.反螺旋策略合成具有力学调控的自旋交叉转变性质的分子三叶结 | Synthesis of contra-helical trefoil knots with mechanically tuneable spin-crossover properties
分子结因其复杂的拓扑结构和潜在应用而受到关注。在更长尺度上连接具有不同拓扑结构的分子结富有挑战性,而利用拓扑特征调控其性质则更加困难。在本文中,我们报道了一种利用两个同轴嵌套的多股反螺旋构建环结的通用方法。为验证这一概念,我们以二价铁为模板,实现了一系列反螺旋三叶结的近定量一步合成。其中包括一个长三叶结——由111个原子构成的近11 nm长的闭环结构。每个结中的两个二价铁中心的热诱导自旋交叉态可通过改变分子内机械张力向反方向进行调控。具有力学可调性质的分子结的合成使其刺激响应多功能性大量涌现。其中一个分子结在结晶时表现出手性自分类,这使得对映体的手动分离成为可能。我们还利用单晶X射线衍射对一种纯有机三叶结(经还原脱金属化获得)进行了表征。
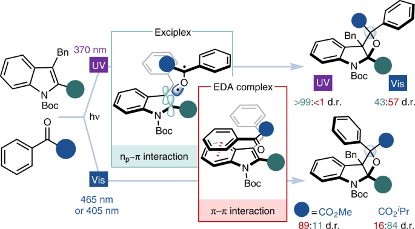
3.揭示光源和位阻因子对杂[2 + 2]环加成反应的影响 | Unveiling the impact of the light source and steric factors on [2 + 2] heterocycloaddition reactions
深入的机理研究所带来的见解可用于控制反应选择性,从而增强合成过程的普适性并促进更多新反应性的发现。在本文中,我们探讨了吲哚和酮之间的光驱动杂[2 + 2]环加成反应(Paternò–Büchi反应)的机理,以深入理解这些过程。我们利用基态紫外-可见吸收光谱和瞬态吸收光谱,结合密度泛函理论计算,发现该反应可借助一种激态复合物或电子供体-受体络合物进行——它们是决定反应立体选择性的关键中间体。我们基于这一发现来控制反应的非对映选择性,并制得了从前无法获得的非对映变体。当辐照波长从370 nm增加至456 nm时,电子供体-受体络合物愈发受青睐,且产物的非对映体比例(d.r.)从>99:<1变化至47:53。与之相反,当甲基取代转变至异丙基取代时,激态复合物更受青睐,d.r.从89:11降至16:84。这项研究表明,研究人员可合理应用光和位阻参数来控制光反应的非对映选择性,开辟立体化学变体的合成路径。
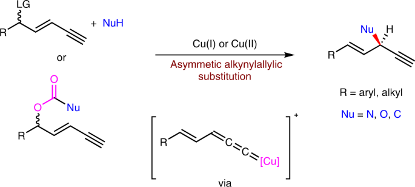
4.铜催化的趋同区域选择性和对映选择性炔烯丙基取代 | Copper-catalysed convergent regio- and enantioselective alkynylallylic substitution
不对称的烯丙基和炔丙基取代已在合成化学中得到了广泛应用,主要用于构筑邻近不饱和C–C键的立体异构源中心。然而,有关两种取代反应融合而成的炔烯丙基取代的研究相对较少,这可能是由于区域选择性和立体选择性控制难以实现。在本文中,我们开发了对映选择性分子间的脱羧炔烯丙基胺化、烷氧基化和烷基化,用于合成一系列1,4烯炔。一价和二价铜盐均是反应的有效预催化剂。该反应能兼容空气和水分而不损失产率或选择性,并能进行克级制备。我们用8种区域和对映异构炔烯丙基氨甲酸酯和碳酸盐底物组成的混合物,以极高的产率和选择性合成了单一产物,证实了该反应的趋同性。单晶X射线衍射和机理分析表明,Cu(I)和Cu(II)过程可能经由不同的、决定对映选择性的过渡态模式进行,涉及多个配体。
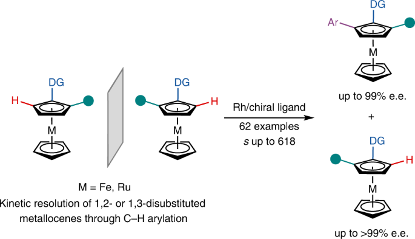
5.利用铑催化的对映选择性C–H芳基化的平面手性茂金属化合物的动力学合成策略 | Kinetic resolution of planar chiral metallocenes using Rh-catalysed enantioselective C–H arylation
平面手性茂金属化合物已在不对称催化、药物化学和材料学中得到了广泛应用。不对称C–H官能化是合成取代手性茂金属化合物的有效途径。然而,这些方法常常受限于特定的茂金属化合物取代模式。在本文中,我们报道了铑催化的1,2-二取代和1,3-二取代吡啶基二茂铁的不对称C–H芳基化。在吡啶基二茂铁的2-位或3-位预先引入取代基,可以极高的对映选择性(选择性因子高达618)合成对映体富集的1,2-二取代和1,3-二取代茂金属化合物,以及相应的C–H芳基化产物。该反应能容忍多种预引入的官能团,包括烷基、烯基、芳基、硅烷基、硫代和氟代,以及1′-环戊二烯上的取代。我们合成并检验了手性二茂铁配体,从而证实了反应的效用。
© nature
Nature Synthesis
关于Nature Synthesis

《自然-合成》旨在汇聚化学及材料合成所有领域的产业和学术界的研究人员,主要发表有机、无机、有机金属和材料化学的原创研究,以及对合成研究界有价值的技术创新,由Ali Stoddart(艾丽·斯托达特)担任主编。该刊标志着Nature Portfolio向应用科学又迈进了一步。”
https://blog.sciencenet.cn/blog-3432244-1377732.html
上一篇:Architectural Intelligence特刊征稿 | 计算性城市设计
下一篇:编辑荐读 | Microchimica Acta精选文章
