博文
阿尔茨海默病的突破:研究人员发现了可能阻止疾病进展的新方法
||
阿尔茨海默病的突破:研究人员发现了可能阻止疾病进展的新方法
诸平
据美国西奈山医院/西奈山医学院(The Mount Sinai Hospital / Mount Sinai School Of Medicine)2024年6月1日提供的消息,美中研究人员合作,在阿尔茨海默病研究方面有所突破,发现了可能阻止疾病进展的新方法(Alzheimer’s Breakthrough: Researchers Discover Novel Way To Potentially Halt Disease Progression)。
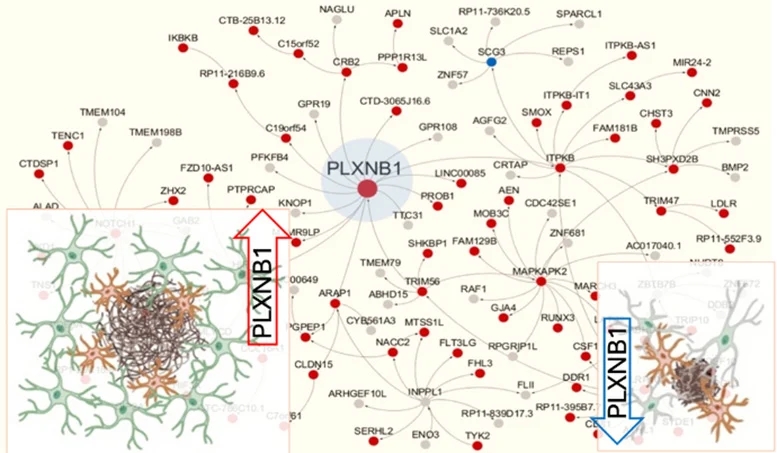
西奈山的创新研究也确定了新的研究途径。西奈山伊坎医学院(Icahn School of Medicine at Mount Sinai)的研究人员在阿尔茨海默病的研究上取得了重大突破。他们的研究确定了一种有希望的方法,可以潜在地减缓甚至阻止疾病的进展。该研究聚焦于反应性星形胶质细胞(reactive astrocytes)和丛蛋白B1蛋白(plexin-B1 protein)在阿尔茨海默病中的作用,为了解脑细胞如何沟通提供了重要的见解,也为创新治疗方法开辟了新的途径。相关研究结果于2024年5月27日已经在《自然·神经科学》(Nature Neuroscience)杂志网站发表——Yong Huang, Minghui Wang, Haofei Ni, Jinglong Zhang, Aiqun Li, Bin Hu, Chrystian Junqueira Alves, Shalaka Wahane, Mitzy Rios de Anda, Lap Ho, Yuhuan Li, Sangjo Kang, Ryan Neff, Ana Kostic, Joseph D. Buxbaum, John F. Crary, Kristen J. Brennand, Bin Zhang, Hongyan Zou, Roland H. Friedel. Regulation of cell distancing in peri-plaque glial nets by Plexin-B1 affects glial activation and amyloid compaction in Alzheimer’s disease. Nature Neuroscience, Published: 27 May 2024. DOI: 10.1038/s41593-024-01664-w. https://www.nature.com/articles/s41593-024-01664-w
参与此项研究的有来自美国纽约西奈山伊坎医学院(Icahn School of Medicine at Mount Sinai, New York, NY, USA)、中国上海同济大学医学院(School of Medicine, Tongji University, Shanghai, China)、中国西安交通大学第二附属医院(Second Affiliated Hospital of Xi’an Jiaotong University, Xi’An, China)以及美国耶鲁大学医学院(Yale University School of Medicine, New Haven, CT, USA)的研究人员。
这项突破性的研究集中在控制丛蛋白B1蛋白(plexin-B1 protein),以提高大脑清除淀粉样斑块的能力,淀粉样斑块是阿尔茨海默病的标志。研究发现,反应性星形胶质细胞在这一过程中起着至关重要的作用。星形胶质细胞是一种在受伤或疾病时被激活的脑细胞。它们有助于控制淀粉样斑块周围的间距,影响其他脑细胞进入和清除这些有害沉积物的方式。
“我们的研究结果通过改善细胞与这些有害斑块的相互作用,为开发新的治疗方法提供了一条有希望的途径,”西奈山伊坎医学院神经科学和神经外科副教授、该研究的共同通讯作者之一罗兰·弗里德尔(Roland Friedel)博士说。这项研究是通过分析比较健康个体和阿尔茨海默氏症患者的复杂数据来推动的,旨在了解这种疾病的分子和细胞基础。
基因网络模型的广泛意义和验证(Broad Implications and Validation of Gene Network Models)
西奈山伊坎医学院神经外科和神经科学教授、该研究的共同通讯作者之一邹红妍(Hongyan Zou音译)博士强调了他们研究结果的更广泛意义:“我们的研究为阿尔茨海默病的研究开辟了新的途径,强调了细胞相互作用在开发神经退行性疾病治疗中的重要性。”
该研究最重要的成果之一是验证了阿尔茨海默病的多尺度基因网络模型。“这项研究不仅证实了我们的基因网络模型最重要的预测之一,而且大大提高了我们对阿尔茨海默氏症的理解。它为开发针对这种高度预测网络模型的新疗法奠定了坚实的基础,”西奈山伊坎医学院神经遗传学威拉德·约翰逊(Willard T. C. Johnson)研究教授、该研究的共同通讯作者之一张斌(Bin Zhang音译)博士说。通过证明丛蛋白B1在阿尔茨海默病中的关键作用,该研究强调了靶向治疗破坏疾病进展的潜力。
研究小组强调说,虽然这是阿尔茨海默病治疗的重大进展,但要将这些发现转化为人类患者的治疗方法,还需要进行更多的研究。
“我们的最终目标是开发出能够预防或减缓阿尔茨海默病进展的治疗方法,”张斌博士补充说,并概述了该团队对进一步探索丛蛋白B1治疗潜力的承诺。
该研究由美国国立卫生研究院国家衰老研究所(NIH National Institute on Aging简称NIA)资助{NIH National Institute on Aging (NIA) grants U01AG046170, RF1AG057440, RF1AG077828, R01AG068030 and R21AG077168},是NIA领导的加速药物合作伙伴-阿尔茨海默病(AMP-AD)靶点发现和临床前验证计划{NIA-led Accelerating Medicines Partnership – Alzheimer’s Disease (AMP-AD) Target Discovery and Preclinical Validation program}的一部分。此次合作的目的是缩短从发现潜在药物到开发阿尔茨海默病治疗和预防新药之间的时间。本研究还得到了阿尔茨海默病协会研究基金(Alzheimer’s Association Research Grant AARG-22-928419)和美国纽约州卫生部门 (New York State DOH grant SCIRB C39068GG)的资助。
上述介绍,仅供参考。欲了解更多信息,敬请注意浏览原文或者相关报道。
Communication between glial cells has a profound impact on the pathophysiology of Alzheimer’s disease (AD). We reveal here that reactive astrocytes control cell distancing in peri-plaque glial nets, which restricts microglial access to amyloid deposits. This process is governed by guidance receptor Plexin-B1 (PLXNB1), a network hub gene in individuals with late-onset AD that is upregulated in plaque-associated astrocytes. Plexin-B1 deletion in a mouse AD model led to reduced number of reactive astrocytes and microglia in peri-plaque glial nets, but higher coverage of plaques by glial processes, along with transcriptional changes signifying reduced neuroinflammation. Additionally, a reduced footprint of glial nets was associated with overall lower plaque burden, a shift toward dense-core-type plaques and reduced neuritic dystrophy. Altogether, our study demonstrates that Plexin-B1 regulates peri-plaque glial net activation in AD. Relaxing glial spacing by targeting guidance receptors may present an alternative strategy to increase plaque compaction and reduce neuroinflammation in AD.
https://blog.sciencenet.cn/blog-212210-1436596.html
上一篇:麻省理工学院的科学家发现极端条件下惊人的金属行为
下一篇:吃植物,战胜癌症:新的研究表明蔬菜可以降低患前列腺癌的风险