博文
非经典生物操纵:富营养淡水水体中力克蓝藻水华的强力生态技术
|
蓝藻水华在全球富营养淡水水体中频繁发生,对生态系统和人类健康构成潜在威胁。然而,在大型湖泊中通过削减营养盐来控制蓝藻水华常常是一件困难又昂贵的事情。作为一种生态的解决办法于20世纪70年代提出的生物操纵(Biomanipulation)曾被认为是对抗蓝藻水华的一种有效方法。后被区分为经典生物操纵(Traditional Biomanipulation,TB)和非经典生物操纵(Non-traditional Biomanipulation,NTB)两类,分别利用滤食性的浮游动物——溞(Daphnia)和滤食性的鱼类——鲢(Hypophthalmichthys molitrix)、鳙(Aristichthys nobilis)。关于TB,已有很多综述论文,而鲜有专门针对NTB的综述论文。在这里,我们首先回顾鲢、鳙能否消化蓝藻的争议,之后,我们分析42个明确描述了蓝藻变化的实验研究,发现在88%的实验中,滤食性鱼类显著降低了蓝藻的丰度,特别是在武汉东湖主湖区(面积12.8 km2)进行的全湖实验中,通过科学调控鲢、鳙的养殖密度,有效地将蓝藻水华的覆盖面积从2021年的接近87%降低到了2022年的0%。最后,我们讨论了影响NTB有效性的可能因素,发现它不仅与鱼类的现存量、生态位分化和形状嗜好性有关,也受到水体营养状态的影响。特别是,与丝状蓝藻相比,鲢、鳙能更有效的摄食群体微囊藻,但也导致小型藻类的增多。NTB能被用于防止或削减Daphnia不能摄食的水华蓝藻,从而为遏制富营养水体中的严重的蓝藻水华提供了一个有效的、可持续的湖内生态技术。
(原文链接:https://doi.org/10.59717/j.xinn-life.2023.100038)

前言
早在150年前,George Francis就关注到了淡水中蓝藻水华引起的问题1。在过去的50年间,有毒蓝藻水华(特别是微囊藻、鱼腥藻、束丝藻或颤藻)在全球的发生频率、规模和持续时间都呈增长的趋势2-5,主要是城镇化、工业化和农业活动增强引起的日益严重的富营养化所致6。这不仅影响了水域生物多样性和食物网的功能7-11,还威胁到了饮水、渔业、旅游和野生生物的安全3, 12-18。蓝藻水华是高度动态的,其生长与损失过程能在数天的时间尺度上发生,(表面水华)出现和消散甚至在更短的时间尺度上发生2。湖泊中的蓝藻水华不仅受外部因素的影响(如营养盐、光照、温度、水文条件)19,也受到水生态系统内部复杂相互作用(如蓝藻和大型植物之间的竞争,Daphnia、浮游植物食性鱼类、双壳类以及噬菌体的摄食等)的影响20。因此,外部物理化学影响和(或)内部生态互作的调控能被用于减轻蓝藻水华21, 22。此外,蓝藻水华和内源磷负荷能相互促进23, 24,形成一个正反馈环路。
将内外源负荷削减到限制蓝藻水华发生的水平是最有效和最持久的解决办法,但这非常昂贵,往往需要数年或数十年时间,并以整个流域为目标,需要国内甚至国际间的共同努力3, 25。例如,为了减少太湖(面积2338 km2)的营养盐,在过去的15年期间,已投入超过1000亿人民币,但蓝藻水华的覆盖面积在2017年5月16日还是达到了1582 km2 26。各种杀藻剂或表面水华的收集仅能作为一种临时措施22。生物控制主要包括微生物(病毒、致病性细菌或真菌)以及各种滤食动物,如Daphnia、浮游植物食性鱼类和双壳类。在这些方法中,通过移去食浮游动物鱼类或引入凶猛鱼类的食物网操纵是20世纪70年代以来的流行方法27。相反,很少关注用食浮游植物的鱼类——鲢、鳙28,可能是因为在北美和欧洲,这样的鱼类稀少。
在这个综述,我们不打算回顾TB对浮游植物的整体影响,因为已有很多这类综述10, 20, 29-35。在简要介绍TB的起源和面临的挑战之后,我们聚焦NTB有效性的验证,从关于鲢、鳙是否能消化蓝藻的争议到42个(大部分来自中国)在围隔、池塘、水族箱或水厂预沉池中进行的实验以及一个全湖实验。纳入该综述的实验研究都是明确描述了鲢、鳙对蓝藻的影响,而那些仅报道了对藻类总丰度或叶绿素a影响的研究则未包含在内。
生物操纵之旅
起源
通过操纵食物网来增加大型浮游动物从而达到控制过剩藻类生长的思想可追溯到20世纪50年代末。在那之前,湖沼学研究仅关注物理、化学因子对浮游植物、进而通过食物链向上对浮游动物、最后对鱼类产生的影响,鱼类未被作为驱动变量(driving variable)而仅作为响应变量(response variable)来看待36, 37。从20世纪50年代末到60年代初,Hrbacek等38、Brooks和Dodson39的工作使湖沼学家开始注意到顶级消费者(如鱼类)亦能对水生态系统食物链较低级的生物(如藻类)产生深远的影响。之后,Hurlbert等40在人工中宇宙(mesocosms)实验中发现,食蚊鱼(Gambusia affinis)减少了轮虫和甲壳动物,从而导致浮游植物的增加和透明度的下降,因此,他们认为可通过操纵鱼类种群(特别是通过人为增加凶猛鱼类)来降低湖泊中的浮游植物丰度。在这些研究的基础上,Shapiro等27首次提出了“生物操纵”的概念,指通过一系列对生物及其生境进行操纵的水体生物群落管理来减少藻类(特别是蓝藻)生物量的方式。此外,欧洲学者喜欢在一种限定意义上使用该词,常常称之为下行(top-down)操纵,即通过增加凶猛鱼类来减少食浮游动物鱼类,进而促进浮游动物种群的发展以增加对浮游植物的牧食压力。Daphnia常常被认为是控制藻类生物量的最合适浮游动物。鱼的操纵可通过添加或移去凶猛鱼类、毒鱼等措施41。一个缺点是,生态系统的结构和过程既受到下行效应的影响,同时还受到上行效应的影响,这使对生物操纵措施结果的定量预测十分困难42-44。但是,生物操纵完全是自然的,既不使用化学药剂,也不需要机械装置,虽然有研究认为,生物操纵对藻类组成和生物量分布的改变并不是富营养化的生物控制45。
从希望到失望
对蓝藻水华的控制需求始于20世纪70-80年代,那时对富营养化的负面影响已到了无法容忍的地步2,出现大量试图通过鱼类的营养级联效应(trophic cascading effects)来增强浮游动物对浮游植物牧食的研究,虽然这些措施的成功率有限。在短期内无法对氮、磷进行有效削减的情况下,作为对抗蓝藻水华的措施,生物操纵曾被寄予厚望。一时间无数实验室、池塘、围隔和全湖的实验研究蜂拥而至,试图验证“下行”操纵的有效性37, 46。虽然这些努力看似成功,但并非总是如此,面临如何使生物操纵的效果稳定持久的挑战41。虽然常常被誉为一种最佳的途径,“下行”操纵并未如预期的那样得到普遍支持,因为大部分包含凶猛鱼类引入的生物操纵并未能降低藻类丰度47。几乎没有研究报道仅通过凶猛性鱼类的投放成功降低了蓝藻的案例20。滤食性贝类也是生物操纵的候选者,但在实践上利用它们去吞食表面蓝藻水华是困难的,因为这些无脊椎动物是底栖性的。生物操纵似乎只是营养盐削减的短暂的替代品。
许多生物操纵措施最初的结果十分壮观,但仅有少数能在数年时间中维持低藻类生物量的48。有若干原因导致利用枝角类进行的生物操纵难以稳定。它不仅依赖于捕食者和猎物之间——凶猛鱼类与食浮游生物鱼类之间或食浮游生物鱼类与浮游动物之间——的定量关系,也受到这种关系的持续性的影响。为了控制食浮游动物鱼类,不同年份、不同湖泊之间出现很大差异,导致牧食性浮游动物的丰度和体积分布的差异,最终导致藻类丰度、种类组成和透明度的差异41。即使最初的操纵成功,也会因为浮游动植物的种类更替、浮游动物-底栖动物食性鱼类的再侵入、不可食藻类的繁衍、以及营养盐循环的变化等因素的影响使生物操纵的效果逐渐变差。因此,在大部分情况下,适度的维持是需要的49。变化也可能源自水动力的随机变化50。虽然能建立清水期,但Daphnia在大多数情况下无法摄食形成水华的群体或丝状蓝藻51,因为它们滤食的颗粒大小是有限制的52-54。Daphnia的寿命短,季节更替快。甲壳类的滤食甚至还可能改变浮游植物的群落结构,有利于难以被其摄食的丝状蓝藻或微囊藻群体的发展,反而增加生物操纵后有毒水华形成的风险20, 55, 56。在暴露于有毒微囊藻的情况下,小型枝角类比大型枝角类对微囊藻毒素的适应性更强,这为富营养水体中在夏季蓝藻水华期间经常出现的Daphnia的优势被小型枝角类所取代的现象提供了一种生态毒理学解释57。鉴于上述事实,Daphnia既不能减少其无法摄食的蓝藻的种群数量,也不能耐受蓝藻毒素。
认识鲢、鳙消化蓝藻的漫长之旅
20世纪90年代末,生物操纵被区分为经典和非经典两类,前者指利用浮游动物来减少浮游植物的操纵,后者指利用滤食性鱼类——鲢、鳙来减少群体蓝藻的操纵58。食浮游生物鱼类用两种不同的行为来摄食浮游生物:颗粒捕食(particulate feeding)和滤食(filter feeding)。颗粒捕食者利用视觉捕食单个饵料,属于浮游动物的“主动-视觉选择捕食者active-visibility selective predators”,而滤食者吞进一定体积的水,在水通过鳃耙时截住饵料,属于浮游动物的“被动逃跑-选择捕食者passive escape-selective predators”加浮游植物的“被动体积-选择牧食者passive size-selective grazers”59。鲢、鳙是中国的主要商业鱼类,以浮游动物、浮游植物和微小碎屑为食。但是,亚洲之外鲜有利用滤食性鱼类来控制蓝藻水华的。生活在热带的罗非鱼虽然有一定的滤食特性,但它难以度过温带或亚热带地区的冬季。在东亚之外,鲜有利用滤食性鱼类成功控制蓝藻的案例20。
摄食什么?
鲢、鳙养殖起源自唐代(公元618至907年),那时开始了池塘四大家鱼的混养。根据南宋罗愿在《尔雅翼》的记载,认为鲢、鳙摄食草鱼粪便。这种观点一直持续到20世纪40年代,主要是由于混养过程中,饲养青鱼和草鱼都是有意识地投喂饵料,而鲢、鳙虽不投饵也同样能长大,因此误认为它们以草鱼粪便为食60。
虽然我国对鲢、鳙的养殖已有很长的历史,但直到20世纪50年代,人们才科学认识了它们的食性——主要是滤食浮游生物。关于鲢鳙食性的科学研究始于20世纪50年代初,倪达书和蒋燮治61基于肠含物的显微分析、肛门附近肠含物的培养及鳃耙结构的显微观察对自然水体的鲢鳙食性进行了研究,发现鲢鳙的食性有所区别:鳙主要以浮游动物为食(浮游动物与浮游植物个数之比=1:4.5),而鲢则主要以浮游植物为食(浮游动物与浮游植物个数之比=1:248)。基于δ15N质量平衡模型,浮游动物在鲢、鳙饵料中的贡献分别为54%和74% 62。
但是,由于鲢、鳙缺乏挑选食物的能力,鳙也带吃一些浮游植物,鲢也吃一些浮游动物,而鲢、鳙食性的差异主要是由于进行过滤的鳃耙的构造不同所致,即鳙的鳃耙较稀,而鲢的鳃耙较密(表1)。例如,由于鳃耙间隙位于20至 25 µm范围64,鲢选择性的摄食20 µm以上的颗粒85。鲢的消化管也长于鳙,与这种食性的差异相一致,因为食物在长的消化管中移动可延长其对消化酶的暴露时间从而有利于对藻细胞的有效消化。
表1 鲢、鳙摄取的食物大小和鳃耙间距
研究 | 摄取的藻类的大小和形状 | 鳃耙间距 | ||
鲢 | 鳙 | 鲢 | 鳙 | |
Fang 192863 | 68-85 µm | |||
Voropaiev 196864 | 20-25 µm | 40-60 µm | ||
Wilamovski 197265 | <20 µm | |||
Iwata 197666 | 10-15 µm (鱼体长 4-5 cm) 18-22 µm (鱼体长23 cm) | |||
Kajak等197767 | 大部分>30 µm | |||
Schroeder 197868 | 20-50 µm | |||
Cremer和Smitherman 198069 | 8-100 µm (主要为17-50 µm) | 17-3000 µm (主要为50-100 µm) | ||
Liu 198170 | 15-25 µm (鱼体长1.5-10 cm) 34-41 µm (鱼体长34-47 cm) | |||
Hampl等198371 | 12-26 µm | |||
Spataru等198372 | 34-37 µm | 84-87 µm | ||
Smith 198973 | 10-500 µm | |||
Herodek等198974 | >10 µm | |||
Xie和Liu 1991, Xie 1999, 200175-77 | 4.0-20.5 (大部分 8-20) µm | 8-20 µm | ||
Sun和 Meng 199278 | >25 µm (鱼体长0.8 cm) >10 µm (鱼体长>5.6 cm) | >25 µm | ||
Liu 等199379 | 23-50 µm (鱼体长0.6-1.0 cm) 8-20 µm (鱼体长>3 cm) | |||
Wang和 Guo 199480 | 22-45 µm | |||
Li和Dong 199681 | 小至3.2 µm | |||
Voros等199782 | >10 µm | |||
Zeng 200183 | 25-30 µm | 35-41 µm | ||
Lu等200584 | 62±18 µm (鱼体长19 cm) | |||
消化什么?
关于鲢、鳙能消化哪些藻类不能消化哪些藻类的问题争议了很长时间。一般来说,对藻类利用的前提是对其细胞壁的分解,可能的机制主要有三种:酸解、酶解或机械破碎86。罗非鱼是典型的酸解机制,它在对蓝藻细胞壁进行分解消化作用时体内胃液的pH值只有1.25甚至1.0,这使其特别适合酸解机制87-89。然而,无胃的滤食性鱼类例如鲢、鳙肠液的pH值通常大于6。此外,鲢、鳙肠液内还缺乏纤维素酶,这就使得它用酶解来对纤维素细胞壁进行分解十分困难61, 90。鲢、鳙对藻类消化的争议持续了数十年。从肠含物和消化酶的分析认为很难消化,而利用放射性同位素技术进行的食物同化率测定表明其具有合理的同化效率。
倪达书和蒋燮治61关于鲢、鳙对藻类消化的结论并不准确。他们根据肛门附近肠含物的培养结果认为,鲢、鳙对金藻、甲藻、隐藻和硅藻消化良好,而凡是具有厚的纤维质细胞壁或胶质的藻类(如蓝藻、绿藻、裸藻)都是不能被消化的种类,因鲢、鳙缺乏分解纤维和胶质的酶。
之后的研究,有的支持这一观点,有的否定这一观点。两种丝状蓝藻——颗粒颤藻和werrzeri鱼腥藻通过鲢肠道时并未受损,而硅藻和原球藻被消化了91。通过荧光显微镜观察,从鲢摄食有毒的铜绿微囊藻排出的粪便中发现了大量死的和活的细胞92。在鲢肠道的最后段中的丝状蓝藻细胞(主要是被选择性摄入呈群体形态的水华束丝藻)的结构与从四个Masurian湖泊中采集的浮游生物中的同样种类并无差别,表明这些藻未被消化67。与活藻相比,分解的藻类能更好的被鲢消化吸收93。通过比较鲢前肠和后肠的肠含物中浮游植物的组成及细胞完整性的变化情况发现,栅藻在前肠和后肠中均具有完好的细胞壁和细胞核,表明栅藻不能被鲢消化,而裸藻在后肠中甚至比在前肠中更活跃90。通过肠液孵育实验发现,在鲢的肠液中孵育了9小时之后,一种丝状蓝藻——水华鱼腥藻仅有9.5%的蛋白质降解为自由氨基酸94。而一系列同位素(32P、14C)示踪研究却表明,鲢、鳙能有效地消化利用蓝藻、绿藻和裸藻74, 95-101。
怎样消化?
野外研究揭示了中心纲硅藻——小环藻在鲢、鳙肠管内的破碎过程75-77。之所以选择小环藻是因其有一个坚硬的、难以消化的硅酸盐细胞壁,且在显微镜下容易识别。完好的小环藻细胞在通过咽喉到达鲢鳙前肠前端时,有多达50-60%被破损,而从前肠前端到肛门的细胞破损率仅为15-20%,在粪便中依然有20-30%的细胞完好无损。这表明鲢鳙咽齿的机械研碎在藻类细胞壁的破碎中扮演了重要角色。董双林102利用栅藻进行的实验研究也得出了类似的结果:栅藻细胞的破碎率从水中的6.4%大幅上升到肠前段的18.8%,到肠后段进一步小幅上升到22.0%,加沙之后这些比例变为4.4%、11.4%和14.1%,表明沙的存在干扰了咽齿的碾磨效率,也证实了咽齿机械磨碎的重要性。
咽齿的机械磨碎可以帮助解释鲢、鳙对藻类消化的矛盾结论。在经过肠道时,一些藻类细胞仍然完好无损,这就导致了一些学者的错误结论,即藻类很难被消化利用61, 86, 90, 94。虽然含完整细胞壁的藻类在经过肠道时变化很小,但这并不防碍鱼体肠道对破碎或损伤了的藻类细胞的活跃的同化吸收作用,这就是为什么用同位素技术测定鲢、鳙对一些蓝藻、绿藻和裸藻的吸收同化率时,总能得到较高值的原因。即使在鲢、鳙的后肠或粪便中发现了完整的或活体的藻类61, 94, 103,也并不能说明该种藻类就没有被鱼体所消化利用。食物的消化率必定是由从食物中所获得的能量输入和消化食物所需要的能量支出之间的平衡所决定的,不完全消化机制可能是无胃的、滤食性鱼类的一种适应性策略,因它们不停的摄食浮游生物以及营养价值不高的有机碎屑76, 77。
它们能消化(有毒)蓝藻吗?
利用14C方法,Panov等97发现,鲢、鳙偏好摄食蓝藻,因其对鱼腥藻和束丝藻的同化率比几种绿藻好。利用32P方法,石志中等98发现,鲢鱼苗对螺旋鱼腥藻的平均利用率高达71.3%。朱蕙和邓文瑾101发现,鲢、鳙对铜绿微囊藻的同化率分别为35-48%和23-38%。基于14C方法,鲢鱼苗对水华鱼腥藻的同化率为17%。
由于水华蓝藻具有浮力,鲢、鳙的不完全消化策略就意味着鱼粪会在水中漂浮,将有机会被鲢、鳙反复摄食,就能获得更彻底的消化,这也许是一种有效的消化利用策略。陈少莲和刘肖芳104发现,鲢、鳙对鱼粪(鱼摄食微囊藻后排出的粪便)的消化率分别为68.6%和58.5% ,远高于第一次摄食微囊藻的消化率(分别为29.5%、26.1%)105,推测鱼粪中滋生的细菌对促进鱼类的消化可能也起到了积极作用。
在蓝藻水华严重的太湖梅梁湾进行的大型(~1 km2)原位围网实验中,鲢不仅有效的摄取了微囊藻细胞(在浮游植物总量中的占比高达84.4%),还实现了快速生长:仅一年时间平均体重从141 g增加到了1759 g106。鳙的结果类似107。野外研究表明,在太湖蓝藻水华期间,食浮游植物的鲢、鳙的肝脏仅有轻微的超微结构变化,而肉食性鱼类的肝细胞则出现了严重的损伤,如内膜系统肿胀,核出现变形。鲢、鳙对有毒蓝藻抗性很强108,它们不仅生长快,而且其肝脏——微囊藻毒素的主要靶器官——仅积累了低水平的微囊藻毒素,这可能得益于其肝脏高效的解毒能力以及其肾脏通过微囊藻毒素与谷胱氨肽(GSH)或半胱氨酸(Cys)结合活跃的排泄能力7, 109。因此,利用鲢、鳙来遏制有毒蓝藻水华是完全可能的。
非经典生物操纵实证之旅
海外早期之争
鲢、鳙是东亚特有的鲤科鱼类,在江河中产漂流性卵进行繁殖110, 111。鲢的自然分布区北至中俄交界的黑龙江,南到中越交界的红河,而鳙的北界仅分布到海河,南至珠江。鲢、鳙现已传播到了非洲、北美洲、南美洲、新西兰和欧洲。鲢、鳙的引种虽可追溯到19世纪末,但主要发生在20世纪60年代至80年代 112。
在中国家鱼被引入前,在欧洲商业上有重要性的植食性鱼类几乎没有。而从中国引入鲢、鳙的最初目的可能与池塘中鲤(Cyprinus carpio)的养殖有关。鲤起源于中国、日本和中亚,是人类重要的食物,它可能是首个在全球被广泛引种的鱼类。自中世纪以来,经历了全球范围内的一系列的引种后,鲤现在几乎遍及了气候条件允许其生存的所有地方113。
数世纪以来,鲤的单养在欧洲的池塘养殖中一直占有主导地位。由于鲤的食性很广,几乎可消费其它鱼类摄食的所有无脊椎动物,因此在欧洲,历史上将土著鱼类与鲤混养的努力一直未能成功。与中国的池塘混养相比,在欧洲鲤的单养面临的问题是如何改善池塘水质、以及如何充分利用饵料资源以提高总产量。鲢、鳙被引种到欧洲的早期,科学家和管理者产生浓厚兴趣的主要原因有二个:1)在欧洲没有本地产的食浮游生物的滤食性鱼类,2)鲢的引入既可改善水质,又能收获另外的食用鱼114。
鲢、鳙大约于1964-1966年间从前苏联引种到波兰114。之后,人们开始感兴趣如何利用鲤未摄食的食物增加鱼产量,此外,由于鲢摄食浮游植物,人们希望鲢能用于控制蓝藻水华以改善水质115。通过混养增加产量容易确认,但关于鲢、鳙是否能改善水质(至少以藻类丰度来说)却存在争议。到了20世纪70年代初,鲢才被引入到北美,其主要目的是为了改善斑鮰和对虾池塘养殖中的水质。鱼池中浮游植物过量生长和分解是一个问题,因为这会引起夜间缺氧而导致鱼类死亡,而如果使用化学药剂又会破坏鱼的风味116。
但是20世纪60年代至80年代在东欧和美国的施肥养殖池塘进行的利用滤食性鱼类控制藻类的试图并不如意,甚至是负面的结果,可能一方面鱼类滤食不足,另一方面在小型浅水水体中鱼类对沉积物的扰动强烈,在这样的池塘中,浮游植物生产力极高,浮游动物群落被上行效应所控制,即鱼对营养盐的再循环胜过了它们对藻类的滤食。例如,Januszko117于1968年(4-10月)在26个养鲤池中研究了三种1龄大小的植食性鱼类——鲢、鳙和草鱼——分别与鲤混养对浮游植物群落的影响。在施肥的情况下,当鲢密度为1500 ind. ha-1时,浮游植物生物量上升了10% (从38 mg L-1到42 mg L-1),当鲢密度增加至3000 ind. ha-1时,浮游植物生物量则下降了10%。而鳙(1500 ind. ha-1)与鲤混养导致浮游植物生物量上升超过了100%(从27 mg L-1到66 mg L-1)。鲢导致硅藻比例上升,鳙导致丝状蓝藻比例大幅上升。但Januszko认为,在鲢3000 ind. ha-1池塘中植物生物量出现10%的下降不是由于鱼类的摄食所致,而是另有其其因。Opuszynski118研究了不同鲢密度对鲤养殖池塘水质的影响。鲤的养殖密度为 4000 ind. ha-1, 鲢的养殖密度为0、4000、8000和12000 ind. ha-1。结果表明,鲢的养殖导致浮游植物净生产量的大幅增加,浮游植物生物量、叶绿素a含量及浮游植物总生产量也有显著增加(虽然幅度较小),而浮游动物的密度及生物量均有一定的降低。混养了鲢、鳙的斑鮰池塘中的藻类生物量显著升高119。鲢被用于改善对虾养殖池塘(0.4 公顷)中的水质,但在含有鲢仅30尾的池塘中总叶绿素a浓度上升了约40%。在混养了鲢的对虾池塘中,>10 µm藻类的叶绿素a持续降低,而<10 µm藻类和总藻类的叶绿素a却增加了120。
来自中宇宙实验的证据
有若干经典的围隔实验表明滤食性鲢、鳙对蓝藻水华的控制能力。第一个实验来自波兰一个类似池塘的Warniak湖,Kajak 等115于1973年进行了一个围隔实验,发现鲢在30g m-3和 90 g m-3的密度下,导致浮游动物生物量分别下降了4.5和16倍,使浮游植物生物量均锐减了4.5倍,也导致群体蓝藻(主要是铜绿微囊藻)比例的下降。遏制效果明显,但他们的解释颇为牵强:“从鱼的增重小可以判断,这些鱼的摄食强度颇低……包括微藻在内的浮游生物的生物量很低,这不是被鱼消费了,而水中稍低的有机和无机物质的数量毫无疑问是沉淀的结果,被鲢摄取的悬浮物随后作为粪便排出”。第二个实验是在巴西的Paranoa水库,Starling和Rocha于1988年进行了围隔实验,发现高密度(125 g m-3)的鲢降低了丝状蓝藻——拉氏拟柱孢藻的生物量,虽然幅度没有预期的那么大121。第三个是在中国武汉东湖进行的系列围隔实验(1989年、1990年和1992年),发现鲢和鳙(无论是单养还是混养)当密度超过一定阈值(>50 g m-3)就能通过直接牧食有效遏制或快速清除微囊藻水华21, 75, 122-124。
迄今为止,已有大量的实验研究(主要来自中国)证实鲢、鳙控制蓝藻水华的能力,主要是围隔实验,也包括若干池塘、预沉池和水族箱实验。在列举的实验系统(特别是对照)中,浮游植物均为群体或丝状蓝藻占优势,在88%的实验中,超过一定密度的鲢、鳙均能有效的控制蓝藻(特别是微囊藻)水华(表2)。
表2 鲢鳙在各种实验系统对蓝藻的影响
研究 | 地点 | 设计 | 时期 | 对蓝藻的影响 |
有效果的围隔实验 | ||||
Kajak等1975115 | Warniak湖 (波兰) | 鲢 0, 30, 90 g/m3. 每个处理2 个重复. 围隔: 6.25 m2, 1.5m深 | 1973年7月-9月 | 鲢导致蓝藻(主要是铜绿微囊藻)大幅下降。 |
Starling和Rocha 1990121 | Paranoa水库(巴西) | 无鱼、刚果罗非鱼、蓝鳃鱼、tambaqui、鲢. 鱼125g/m3. 每个处理2个重复.围隔: 2 m3水 | 1988年3月- 4月 | 丝状蓝藻——拉氏拟柱孢藻占浮游植物总生物量的98%,为绝对优势种,鲢显著降低了拉氏拟柱孢藻的生物量,而其它3种鱼均增加了拉氏拟柱孢藻的生物量。 |
Xie 和Liu 199175 , Xie 1996124 | 东湖 (武汉) | 0, 鲢72 g/m3, 鲢36 g/m3 + 鳙182 g/m3. 围隔: 6 m2, 2 m深 | 1989年5月-10月 | 无鱼围隔出现严重微囊藻水华,鲢或鲢鳙混养围隔均无蓝藻水华,东湖湖水(放养有高密度鲢鳙)无蓝藻水华 |
Xie 和 Liu 1992122 , Xie 1996124 | 东湖 (武汉) | 围隔3和4从开始就放鱼。水华出现后,围隔1放鲢71 g/m3,围隔2放鳙84.5 g/m3,围隔5放鲢+鳙共78 g/m3,E6不放鱼。围隔:6 m2, 2 m深 | 1990年4月-8月 | 围隔3、4始终无水华,其余围隔均出现微囊藻水华,之后加入鲢鳙可快速清除水华,无鱼的围隔6中微囊藻水华一直持续下去。东湖湖水(放养有高密度鲢鳙)无蓝藻水华。 |
Xie等 1993123 , Xie 1996124 | 东湖 (武汉) | 围隔1、2始终无鱼。水华出现后,围隔3、4中放草鱼45-50 g/m3,围隔5、6中放鲢21-33 g/m3,围隔7、8中放鳙69-75 g/m3。围隔:6 m2, 2 m深 | 1992年7月-9月 | 无鱼围隔均出现了微囊藻水华。鲢或鳙均能快速降低水华,草鱼则不能。始终未放鱼的围隔1、2水华一直持续下去。东湖湖水(放养有高密度鲢鳙)无蓝藻水华。 |
Li 等1993125 | 东周水库(山东) | 鲢5-41 g/m3+鲤6-120 g/m3。15个处理,每个处理2个重复。围隔: 14 m3水, 5 m深 | 8月18日-9月20日 | 实验开始时铜绿微囊藻和卵形隐藻占优势,并由表面水华。最后,铜绿微囊藻的丰度在鲢围隔减少了91%,但在无鱼围隔中增加了27% 。 |
Starling等1998126 | Paranoa水库(巴西) | 鲢 0, 10, 20, 40, 60 g/m3, 所有围隔均放罗非鱼25 g/m3。每个处理2个重复。 围隔:80 m2, 50 m3水 | 1996年10月-11月 | 无论哪个养殖密度,鲢都显著降低了微囊藻的丰度。 |
Data和Jana 1998127 | 人工湖(印度) | 鲢0,480 g/m3、鳙432 g/m3和罗非鱼384 g/m3,无鱼对照,3个重复。围隔:直径1m,高度1.6m, 0.5 m3水 | 1995年11月-12月 | 在湖水中微囊藻占95%。无论种类,在放鱼后的第3或第7天,微囊藻种群下降了60-93%。对微囊藻的清除能力鲢最高,其次是鳙和罗非鱼。 |
王海珍等2004128 | 滇池(昆明) | 鲢0, 50, 75, 100 g/m3。围隔:100 m2, 0.85 m 深 | 2001年7月-9月 | 三种密度的鲢均能有效控制微囊藻水华。 |
Zhang 等2006129, 胡秀琳等2007130 | 什刹海(北京) | 鲢0、17、51、103 g/m3,每处理2个重复。围隔9m2,1 m深 | 2004年7月-10月 | 在鲢 0、17 g/m3围隔中微囊藻占优势,在51g/m3围隔中水华蓝藻得到有效抑制。 |
蔡建楠等2008131 | 池塘(广州) | 鲢43 g/m3。围隔:25 m2。 池塘作为对照 | 2004年9月-11月 | 实验开始时优势藻类为微囊藻和湖泊鞘丝藻,试验结束时,在鲢围隔中为囊裸藻和卵形衣藻,而在池塘中则为微囊藻和针杆藻。 |
Xiao et al. 2010132 | Gancun水库(广东) | 鲢0, 16, 50 g/m3. 每个处理2个重复。围隔: 100 m2, 4.6 m深 | 2006年10月9日-12月14日 | 群体蓝藻在50 g/m3围隔中减少,在16 g/m3围隔中增加。蓝藻主要有湖生蓝丝藻、伪鱼腥藻、 拟柱孢藻、蓝纤维藻和微囊藻。 |
王嵩等2009133 | 于桥水库(天津) | 鲢10, 30, 60 g/m3,鳙10 g/m3,无鱼为对照。每个处理2个重复。围隔: 300 m2,1.6 m深 | 2007年6月11日-7月19日
| 无鱼围隔中出现微囊藻水华,各有鱼围隔中蓝藻比例低。鲢或鳙10-60 g/m3可降低蓝藻比例,有效遏制蓝藻水华的发生。 |
王丽卿等2011134 | 淀山湖 | 鲢+鳙0,40,80 和120 g /m3,每个处理个重复。围隔:100 m2,2.1 m深 | 2009年6月-9月 | 7月中旬,无鱼组围隔爆发大面积微囊藻水华(优势种为,9 月初,无鱼围隔仍有微囊藻水华,但规模不大。放鱼围隔一直无水华。 |
Yin等 2017135 | 太湖 | 鲢0, 35, 70, 150 g/m3. 每个处理3个重复。围隔:6.25 m2, 1.5 m深 | 2011年5月30日-6月23日 | 实验开始时微囊藻生物量为5.8 mg/L。实验中,微囊藻的平均生物量在0, 35, 70, 150 g/m3 围隔中 分别为 6.5, 2.6, 4.2, 3.9 mg/L. 鲢显著降低了微囊藻生物量。 |
Yi等2016136 | 太湖 | 鱼50 g/m3, 鲢+鳙1:0, 1:1, 1:2, 无鱼为对照. 每个处理3个重复. 围隔6.25 m2, 1.5 m深 | 2011年7月16日-9月3日 | 鲢、鳙均减少了微囊藻生物量,且鲢比鳙更有效 |
杨璇等2013137 | 塘坂水库(福州) | 鱼0, 21 g/m3, 鲢+鳙 (1:1)。每个处理2个重复。围隔:3.2 m × (4-5) m, 1.3 m深 | 2012年4月-5月 | 放养鲢、鳙鱼后,微囊藻从大的群体变到小的群体或单细胞,蓝藻占比下降,硅藻和绿藻占比升高。 |
苏玉萍等2016138 | 山仔水库(福建) | 鲢11, 24 g/m3, 鲢+鳙31 g/m3, 鲢+鳙+鲫31 g/m3, 无鱼为对照。每个处理2个重复。围隔:7.7 m2, 1.7 m深 | 2012年6月-12月 | 实验期间,围隔外微囊藻占比25-96%,对照中为35-94%。试验结束时,放鱼组中微囊藻占比例均低于空白组,在鲢24 g/m3围隔中为15.2%,在鲢+鳙31 g/m3围隔中为6.2%。 |
靳晓彤等2023139 | 流溪河水库(广东) | 小鲢0, 7 g/m3,大鲢7 g/m3。 每个处理3个重复。围隔: 85 m3水 | 2016年11月13日-27日 | 实验开始时微囊藻占优势。实验结束时,与对照组相比,有鱼围隔中>20 µm藻类显著降低,而对照组中微囊藻占优势,在大鲢围隔中,蓝藻占比下降了30%,而在小鲢围隔中,则只下降了6%。 |
无效果的围隔实验 | ||||
Domaizon和 Devaux 1999140 | Villerest 水库(法国) | 鲢0, 8, 16, 20, 32 g/m3。每个处理3个重复。围隔:5.5 m3 水 | 7月23至8月19日 | 实验开始时,蓝藻(主要是微囊藻)密度占比达79.1%。实验结束时,所有围隔中的蓝藻都增加了,其中以8、16 g/m3围隔中蓝藻增幅最大,32 g/m3围隔中增幅最小。 |
有效果的水族箱实验 | ||||
Herodek等198974 | 水源:Balaton湖 (匈牙利) | 鲢2500 g/m3。水族箱:0.03 m3 | 5小时 | 丝状蓝藻的比例从46%下降到了30%,硅藻(>20µm)从30下降到了27%,<20µm从23%增加到了43%。总藻类生物量从65 mg/L下降到了42 mg/L。 |
崔福义2004141 | 培养的藻类 | 鱼30 g/m3 :鲢, 鳙, 鲢+鳙(7:3)。无鱼为对照。3个处理。水族箱:1.2 m3 | 8周 | 蓝藻的比例在鲢水族箱中从65%下降到18%,在鲢+鳙水族箱中从57%下降到13%,在鳙水族箱中从62%下降到55%,在对照中从60%升到65%。 |
郎宇鹏等2006142 | 水源:再生水河道(天津) | 4 个水族箱放鲢(27-35 g m3), 一个水族箱无鱼对照。 水族箱:10 L | 1周
| 实验开始时,微囊藻占比>99%。实验结束时,铜绿微囊藻的密度在放鱼水族箱中降幅超过50%,而在对照水族箱中则增加了近80%。 |
林海等 2009143 | 江苏 | 鲢0, 12, 15 g/m3。水族箱:120 L | 2007年9月16日-23日 | 微囊藻加入水族箱,其丰度在第3天下降了60%,第7天到了零。 |
郭艳敏等2016144 | 培养的铜绿微囊藻 | 无鱼, 鲢(1410 g/m3) + 鳙(910 g/m3), S鲢(1410 g/m3) + 鳙(910 g/m3) +鲴(720 g/m3). 每个处理3个重复。水族箱:100 L | 2015年9月11日-15日 | 鲢鳙显著降低了铜绿微囊藻丰度。 |
陈玲玲等2019145 | 培养的铜绿微囊藻 | 鲢+鳙 (292 g), 鲢+鳙+ 细鳞斜颌鲴 (359 g), 无鱼。 每个处理3个重复。水族箱: 100 L | 2018年5月21日-6月9日 | 鲢、鳙显著降低了叶绿素和铜绿微囊藻的丰度。 |
Shen等2020146 | 水源:太湖 | 鳙0, 80 g/m3。每个处理4个重复。水族箱:500 L | 2018年10月18日-11月5日 | 实验开始时,藻类由小环藻和微囊藻占优势。之后,在由于水族箱,蓝藻生物量明显降低,而绿藻快速增加。 |
Zhang等2023147 | 水源:太湖 | 常规氮、磷负荷而无鳙(F)蚌(C)(对照+1NP),FC+1NP,FC+2NP,FC+3NP,F 80 g/m3 + C 200 g/cm2. 每个处理3个重复。 水族箱:500 L | 2018年9月12日-10月11日 | 对照+1NP水族箱中蓝藻(主要是微囊藻)生物量占2%,绿藻占37%,而,FC + 3NP水族箱绿藻(主要是二形栅藻和二角盘星藻)占74%,硅藻占17%。
|
有效果的池塘实验 | ||||
郎宇鹏等2006142 | 水池(天津) | 鲢 0, 10, 50 g/m3。3个池塘, 每个4 m2, 4 m3 水 | 18天
| 蓝藻比例在无鱼池塘中明显增加,在10 g/m3池塘中变化不大,在50 g/m3池塘中明显下降。 |
梁晓霞等2008148 | 晋阳湖(山西) | 鲢 0, 64, 151 g/m3。每个处理2个重复。池塘:80 m3水 | 2007年6月19日-7月17日 | 鲢降低了蓝藻(主要是颤藻)的比例。 |
Zhang等 2022149 | 千岛湖(浙江) | 鳙 0, 12.1, 24, 33 g/m3。 每个处理2个重复。池塘: 2980-3100 m2, 1.5 m深 | 2016年5月5日-8月16日 | 鳙显著遏制了藻类(特别是蓝藻)的生物量,其中24-33 g/m3池塘比12 g/m3池塘的遏制效果更好。无鱼池塘中的藻类主要由蓝藻组成,包括不定微囊藻、卷曲鱼腥藻和史密斯鱼腥藻。 |
胡志军等2021150 | 千岛湖(浙江) | 鲢0, 10, 20, 30 g/m3。每个处理2个重复。池塘:4800 m3 | 2017年5月-9月 | 在实验中,不定微囊藻占29-58%,史密斯鱼腥藻占10-18%。与对照组相比,有鱼池塘中蓝藻密度下降了39-68%,而20-30 g/m3池塘中蓝藻生物量的降幅达86%-91%。 |
孙龙生等2019151 | 高邮 (江苏) | 在虾塘中,鲢0, 19, 28, 37 g/m2。池塘:11300 m2 | 2018年9月9日-11月8日 | 实验开始时,微囊藻占优势。鲢显著降低了蓝藻(微囊藻)的丰度,最大的下降在37 g/m2池塘,为26%(37%)。 |
无效果的池塘实验 | ||||
Januszko 1974117 | 波兰 | 鲤0.2尾/m2与鳙0.15 尾/m2混养,鲤0.2尾/m2为对照。每个处理3个重复。池塘:2000 m2 | 1968年4月-10月 | 鳙使丝状蓝藻(鱼腥藻)的生物量大幅增加:在未施肥池塘中增加了4倍,在施肥池塘中增加了70倍。 |
唐洪玉等2003152 | 重庆 | 1鱼池( 15 m2) 被分割为4个围隔,鲢0, 163, 489, 815 g/m2 | 9月17-10月7日 | 实验开始时颤藻占比>90%,鲢增加了藻类丰度和叶绿素,鱼的体重从0.61 kg 降到了0.50 kg。 |
韩士群等2006153 | 江苏 | 投饵的混养池塘。鲢 0, 2.5 g m3。每个处理3个重复。池塘:33489 m2, 1.5 m深 | 2003年4月-9月 | 实验期间,蓝藻的平均生物量和占比鲢池塘中分别为40 mg/L和42%,而在对照池塘中分别只有23 mg/L and 27%。 |
Shen等2021154 | 太湖 | 鲢0, 25, 50, 100 g/m3。每个处理3个重复。池塘:18 m3 水 | 2018年5月19日-6月20日 | 实验开始时,微囊藻在所有池塘中占优势(>76%)。试验结束时,所有围隔中叶绿素a都降到了很低的水平(<6 µg/L),微囊藻的比例均有显著下降,虽然在100 g/m3池塘中最高。 |
有效果的预沉池实验 | ||||
马华等2012155 | 预沉池(天津) | 鲢61 g/m3。池:18060 m2, 60000 m3水, 5d停留时间 | 2006年5月10月 | 7月-9月之间,鲢使从进水到出水的蓝藻(微囊藻)降低了77%(80%)。 |
范振强等2008156 | 预沉池(天津) | 鲢0, 65 g/m3池:18060 m2, 50000 m3水, 3.5d停留时间 | 2006年7月-9月 | 原水中的蓝藻占95%。鲢削减了43-95%的蓝藻,或者41-95%的水华微囊藻。而在对照中,从进水到出水,水华微囊藻增加了41%。 |
马华等2009157 | 预沉池(天津) | 鲢65 g/m3。池:18060 m2, 50000 m3水, 4d 停留时间 | 2007年7月-8月 | 鲢显著降低了微囊藻丰度 |
贾柏樱和马华2017158 | 预沉池(天津) | 鲢27 g/m3。池:18060m2, 50000 m3水, 3d停留时间 | 2月-10月 | 在7月-8月,鲢清楚了73-77%的蓝藻。当原水中群体微囊藻占优势时,鲢对蓝藻的摄食效率远高于其它藻类。 |
有少数几个实验研究常常被作为NTB控制蓝藻失败或瓶颈的例子20。在法国Villerest 水库进行的一个围隔实验中,有4个鲢的密度(8、16、20和32 g/m3)和1个无鱼对照,但蓝藻密度(铜绿微囊藻占优势)在所有处理都有增加,最大的增加发生在8和16g/m3围隔中,最小的增加在32 g/m3围隔中140。这个负效应可能是实验期太短(仅有28天)的缘故。如果鲢的密度处于中、低水平,短期的实验可能无法产生显著的效果。当然如果鲢鳙密度足够高,短时间也能产生显著的效果。另一个例子来自Ke等159,他们在太湖制作了3个大型围栏(每个面积0.36 km2),以评价鲢、鳙(密度约40 g/m3)对浮游生物的影响,发现浮游植物总生物量下降了,但与外面的湖水相比,微囊藻生物量和藻毒素浓度的变化并不显著。但由于围栏是由渔网(孔眼2 cm×2 cm)做成的,浮游生物在围栏内外能自由交换。Shen等154的池塘实验仅持续了1个月,在结束时,所有池塘(有鱼或无鱼)中的叶绿素都降到了几乎低于6 µg/L以下的水平,这个叶绿素a水平太低以致难以检验鲢是否能有效控制以高生物量为特征的蓝藻水华。
来自全湖实验的证据
迄今为止,很少有研究通过全湖水平的实验去验证NTB理论的有效性。自20世纪70年代以来,在亚热带浅水湖泊武汉东湖的一个子湖——郭郑湖(面积12.8 km2),每年夏季都会发生严重的蓝藻水华,浮游植物群落主要由形成群体的微囊藻和丝状的鱼腥藻和颤藻占优势21, 160。自1971年以来,国营东湖渔厂每年都投放滤食性鲢、鳙(既不施肥,也不投饵,它们以湖中的浮游生物为食)。但到了1985年,蓝藻水华突然消失了,那时鱼类密度恰好超过了一个临界阈值(50 g m-3)21,之后无水华的状态持续了36年之久,证实了NTB的有效性和稳定性。其实,2000年之后,政府投入了数百亿进行截污控源,大大降低了湖水中的氮、磷水平。
但是,2021年夏天,微囊藻水华突然再次在湖中出现(图1,视频S1),覆盖面积从7月6日的0.06 km2,增加到8月16日的3.46 km2,进一步增加到9月11日的11.2 km2(约占全湖面积的87%)。水华持续了近半年,虽然政府花费了3000多万元应对水华,主要是通过人工或无人机喷洒杀藻剂或将蓝藻泵进下水管网(视频S2)。这表明,湖水中的营养盐(特别是磷)仍然满足蓝藻水华爆发的条件。
 图1 2021年夏季,武汉东湖的蓝藻爆发(A-C)和应急处理——人工喷撒杀藻剂(F)用无人机喷撒杀藻剂(E)以及表面水华的泵出(入下水管网)(D)
图1 2021年夏季,武汉东湖的蓝藻爆发(A-C)和应急处理——人工喷撒杀藻剂(F)用无人机喷撒杀藻剂(E)以及表面水华的泵出(入下水管网)(D)
东湖蓝藻水华的再次发生可归结为若干管理上的变化。首先是鱼类密度不够。2003年之后鲢、鳙密度逐步下降,在2017年至2021年之间下降到了50 g m-3的临界阈值之下(图2)。第二是种类搭配欠合理。鱼类现存量中鳙的占比高达80%,削弱了单位鱼类生物量对藻类的牧食压力。第三是鲢、鳙放养时的规格欠合理。鲢、鳙放养时的体重从100-250 g增加到了750-1000 g,降低了单位鱼产量对藻类的牧食压力。第四是捕捞时间欠佳。鱼类捕捞从冬季延长到了从夏季到冬季的整个时期,从而导致了夏季鲢、鳙对藻类牧食压力的减轻。此外,浮游动物不可能是2021年蓝藻水华爆发的原因,因为从2017年到2020年,浮游动物(特别是甲壳动物)生物量出现了显著的上升,用于经典生物操纵的体型较大的透明溞也有明显增加,虽然数量较少(图3)。
东湖的长期监测数据(图2)也表明了滤食性鱼类对藻类的牧食压力。以年平均来看,鱼类现存量与藻类生物量(r=-0.572, P=0.004)、丝状蓝藻生物量(r=-0.508, P=0.013)和微囊藻生物量(r=-0.320, P=0.136)均呈负相关关系,其中与微囊藻之间相对较低的相关性可能是2021年之前微囊藻生物量太低的缘故。
为了防止微囊藻水华的卷土重来,2022年对若干管理措施进行了调整。首先将2022年的鱼类放养量增加到了2021年的两倍,鲢:鳙调整到2:1,100-250g的小鱼增加到了1/3(视频S3)。第二是捕捞期重新调回到了冬季(2021年出现蓝藻水华后捕捞活动立刻停止了)。根据鱼类声纳探测,鲢、鳙现存量在2022年3月达到82 g m3,在9月增加到192 g m3。这些措施特别成功:2022年尽管武汉市经历了半个多世纪以来最炎热和最干旱的夏天,微囊藻水华被完全遏制住了(即无水华发生)。2022年,不仅没有喷洒杀藻剂的投入,东湖渔厂通过冬季的商业捕捞还获得了可观的利润。据估算,2022年鱼种放养带入了9.9吨氮和2.1吨磷,冬季捕捞带走了17.4吨氮和3.7吨磷,由于水柱中的氮和磷分别为20.9吨和2.8吨,因此当年的渔业活动削减了相当于水柱中36%的氮和57%的磷。这些事实表明NTB不仅有效,还具有环境和经济的可持续性。
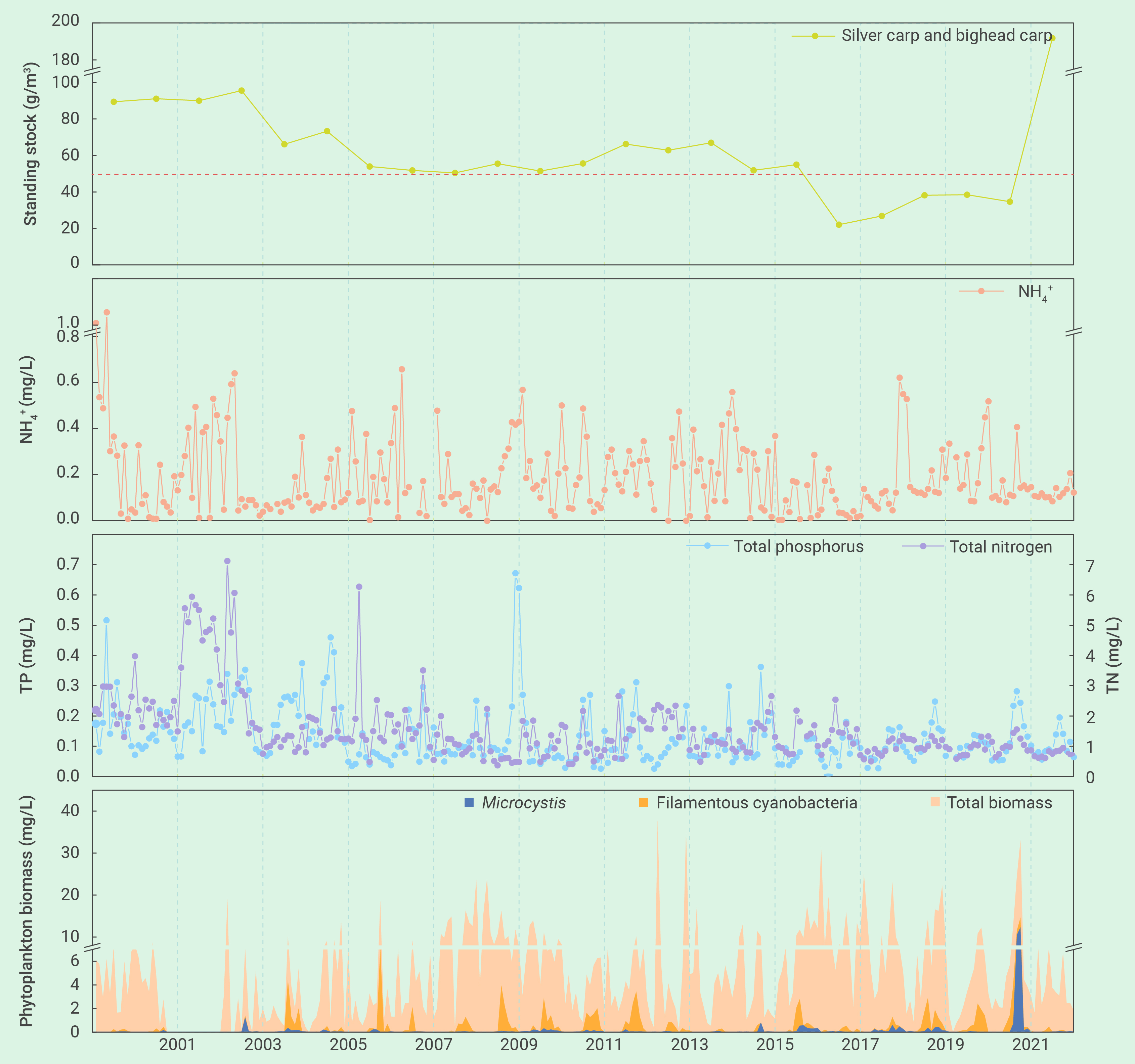
图2 2000年-2022年期间,武汉东湖(湖心监测站)浮游植物和营养盐的季节变化以及鲢、鳙现存量的年际变化。丝状蓝藻包括:长孢藻、鞘丝藻、细鞘丝藻、颤藻、席藻、浮鞘丝藻、假鱼腥藻和尖头藻。在2004年以来鱼类现存量逐渐降低的背景下,2021年突然爆发严重的蓝藻水华,但2022年通过大幅增加滤食性鱼类的放养,蓝藻水华被彻底遏制,证实了NTB的有效性
藻类如何响应滤食性鱼类驱动的营养盐循环一直是人们担心的一个问题。有趣的是,虽然2022年的鱼类现存量比2021年高出4倍多,但湖水中的TN、TP和NH4+浓度的年平均值分别从2021年的1.04 mg/L、0.13 mg/L和0.146 mg/L降到了2022年的0.75 mg/L、0.10 mg/L和0.121 mg/L,藻类生物量也有显著下降(图3)。这表明鲢、鳙排泄物可能会促进自然湖泊的所谓“鱼富营养化”的担心127, 161-166完全没有必要,尽管这种现象在小型实验系统中常常被观察到127, 167, 168。
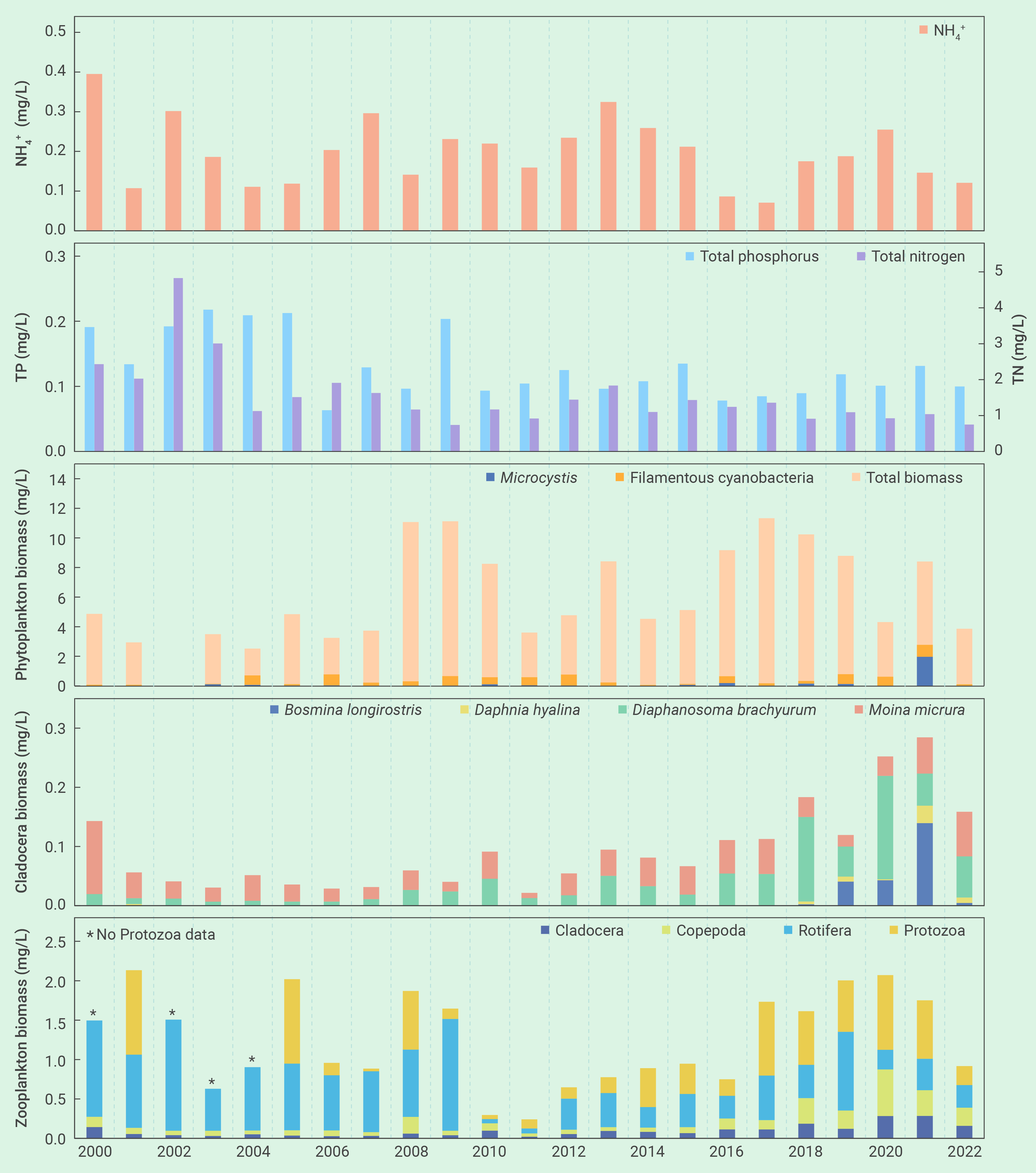
图3 2000年-2022年期间,武汉东湖氨氮、总氮和总磷的年平均浓度、以及浮游植物、枝角类和浮游动物年平均生物量的变化
影响非经典生物操纵有效性的因素
生态位分化
鳃耙孔隙大小被认为是滤食性鱼类滤食能力的最重要决定因素59。鲢、鳙的生态位有所分化,鲢的鳃耙较密,而鳙的鳃耙较稀,在同样的条件下,鲢摄食的藻类比鳙多,但鳙摄食的浮游动物比鲢多。换言之,鲢主要是浮游植物食性,而鳙主要是浮游动物食性。但鲢、鳙也被认为采用机会主义的摄食模式,缺乏稳定的生态位,譬如,浮游植物通常只是鳙食物的一小部分,但在蓝藻水华出现的条件下,藻类能占到其食物的70% 169。
鲢、鳙对食物的选择与其自身的密度也有关,即如果鲢、鳙密度较低,浮游动物在其食物中的比重就会增加,因此会降低对蓝藻的摄食159。在极低的养殖密度下,鲢、鳙之间就很少有竞争,它们均会更多的摄食浮游动物,因此将会减少对蓝藻的牧食效率170。
鱼类密度依赖性
NTB的成功依赖于对蓝藻足够的牧食压力,而这需要足够的鲢、鳙养殖密度。因藻类也是在不断的生长,这就需要鱼类的牧食压力超过藻类或某些需要控制的藻类(如形成水华的蓝藻)的增殖速率。牧食者和藻类对温度的响应基本是同方向的,即随着温度的升高(在一定范围之内),牧食速率和藻类的增殖速率都是增长的。当然藻类的增殖速率还受到其它物理化学因素(如营养盐、光照、降雨、水动力等)的影响。例如,滤食性动物对藻类的控制效果随着营养盐负荷的增高而下降147,可能是由于营养盐驱动的藻类生长速率的增高。
确定一个鱼类临界密度对NTB的应用来说是至关重要的。例如,在富营养的武汉东湖,鲢、鳙的密度需在> 50 g m-3的临界阈值之上,而低于这一临界阈值,蓝藻水华就会卷土重来(图2)。在理想状态下,鲢、鳙的生长速度很快。因此,阈值的选择具有挑战性,即阈值是以初始放养密度(一般年初)还是生长季节的平均鱼类密度或总鱼产量是需要斟酌的。由于不同年龄鱼类的摄食效率是不同的,因此放养时鱼类的大小也会产生一定影响。此外,捕捞时间也会影响藻类群落的动态,从而影响NTB的效果。
形状嗜好
鲢、鳙滤食器官对丝状蓝藻的截留不是那么的有效。在美国佛罗里达的池塘中,鳙选择性摄食一种大小80±51 µm的球状藻类——布朗葡萄藻(Ivelv指数>±0.9),但对两种丝状蓝藻——赖氏鞘丝藻和湖泊浮鞘丝藻(长125-130 µm,宽1-2 µm)就不能有效的摄食(Ivelv指数-0.1 to +0.1)114。在巴西Paranoa水库的围隔实验中,高密度(125g m-3)鲢对拉氏拟柱孢藻的控制效果并非想象的那么强烈121。在Januszko117的池塘实验中,鳙甚至导致蓝藻(主要是水华鱼腥藻、单丝鱼腥藻和阿氏颤藻)比例的大幅上升。在武汉东湖,丝状蓝藻比球状的微囊藻群体更能抵御滤食性鱼类的牧食(图2):微囊藻和丝状蓝藻的平均生物量在2000年-2020年期间分别为0.05 mg/L和0.35 mg/L,在发生严重蓝藻水华的2021年分别为1.97 mg/L和0.81 mg/L,而在鲢、鳙生物量增加了4倍多的2022年又分别降至0.01 mg/L和0.10 mg/L。鲢、鳙看起来更喜欢球状藻类(与丝状藻类相比)(表3),因此,它们对微囊藻的摄食更有效,而对丝状蓝藻就逊色一些。当然,东湖的长期监测数据表明,鲢、鳙也能显著降低丝状蓝藻的丰度(图2)。
表3 鲢、鳙的食物选择和嗜好
研究 | 鲢 | 鳙 |
Savin 1965,91 引自 Opuszynski 1978167 | 相较于尖状栅藻(20 × 30 µm),更喜欢短棘盘星藻(呈直径50 µm的盘状) | |
Chiang 1971171 | 鲢选择性的摄食蓝藻纲和绿藻纲 | |
Iwata 1976172 | 对月牙藻(10 µm)的摄食率低于念珠新月藻(300 µm) | |
Smith 198973 | 在10-70 µm之间,滤食速率随颗粒增大而增大 | |
Opuszynski 等 1991173 | 对小球藻(直径6µm)的滤食率不足0.1%,但对较大的栅藻(直径12 µm)的滤食率增加到13% | |
Opuszynski和 Shireman 1993114 | 相较于丝状藻类(长125-130 µm, 宽1-2 µm),更喜欢布朗葡萄藻(80±51 µm) | |
Dong和Li 1994174 | 在3.2-493 µm之间,清除率随食物大小增加而增加。鲢对藻类的摄食比鳙更有效 | 在3.2-493 µm之间,清除率随食物大小增加而增加。鳙对浮游动物的摄食比鲢更有效 |
Mu等 2012175 | 对蓝藻的Ivlve选择指数(特别是,点形平裂藻17、不定微囊藻5.9和不定腔球藻4.89)远高于其它藻类 | |
Li等2013176 | 蓝藻占浮游生物食物的74.5%,对铜绿微囊藻的Ivlve指数为1.53,对总蓝藻的Ivlve指数为1.42 | 蓝藻占浮游生物食物的56.0%,对铜绿微囊藻的Ivlve指数为1.30,对总蓝藻的Ivlve指数为1.07 |
非经典生物操纵的优缺点
在控制蓝藻水华上,NTB比TB更有优势,因为群体(如微囊藻)或丝状蓝藻(如鱼腥藻和束丝藻)不能被Daphnia摄食51,但能被鲢、鳙摄食106, 107。两种生物操纵的方式完全不同,主要因为它们过滤的食物大小不同。物种寿命的差异也会影响生物操纵的稳定性:Daphnia只能活几个月,但鲢、鳙能活7-8年以上,体重也可达到50-80 kg。
微生物感染或Daphnia牧食可能引起藻类生物量的突然或短期的下降3,但极少能使蓝藻水华持久的降低,而鲢、鳙则能持续性的遏制蓝藻水华达数十年之久或短期内迅速的清除蓝藻水华(图2)。因为鲢、鳙仅在大型河流中繁殖110, 177-179,它们在封闭湖泊中的种群是可控的,即如果停止放流,它们的种群就会逐渐下降。TB通常在较低营养水平(TP<50 µg L-1浅水湖泊,TP<20 µg L-1深水湖泊)及小型藻类占优势的水体有效180。而NTB能应用于发生严重蓝藻(特别是群体微囊藻)水华的富营养或超富营养水体,但不建议用其去控制贫营养或生产力低的水体中的藻类。另一方面,将鲢、鳙引入到非自然分布区的水体时,需要注意对本土生物多样性可能的副作用181-184。
鲢、鲢可能促进微藻的增殖,因为它们不仅移去了微藻的竞争者(大型藻类),也移去了自己的消费者(滤食性浮游动物)67, 115,但是,相反的结果也出现在施肥的养殖池塘中117。控制藻类与控制蓝藻不完全是一回事,蓝藻只是藻类的一部分。能形成表面水华的蓝藻均具有伪空泡,因此才能漂浮于水面,以微囊藻居多,还包括一些丝状蓝藻。由于鳃耙结构的限制,鲢鳙以过滤10-20 μm 以上的大型藻类为主(表1),但这却为小型藻类的增殖提供了更多的生态位,有利于其繁衍,有时甚至导致更高的藻类总密度,因此使透明度下降185。滤食性鱼类的摄食也可使微囊藻的群落由大变小186。鲢、鳙养殖不一定导致藻类生物量、叶绿素a或营养盐(氮、磷)的同步下降,但能有效控制藻类群落的体积结构。因此,NTB用于控制形成群体的蓝藻水华,而不一定是藻类总密度。虽然滤食性鱼类是“被动的体积选择牧食者”,但它们通过直接牧食对藻类的影响是其摄食速率和藻类生长速率互作的结果,后者通常随藻类体积的增大而下降59,也有利于小型藻类的增多。
总之,NTB被证实是一种控制蓝藻水华的强有力的湖内生态技术,特别是当营养盐在短期内无法有效削减的情况下,它具有见效快、稳定性好、对环境友好和经济上可持续等优点。作为富营养化系统治理的一部分,现在已经到了通过强化NTB去解决大型富营养湖泊中蓝藻水华问题的时候了,虽然这富有挑战性。我们期望这篇综述能为决策者使用NTB提供良好的科学基础。
参考文献
1. Francis, G. (1878). Poisonous Australian lake. Nature 18, 11-12.
2. Ibelings, B.W., Fastner, J., Bormans, M., et al. (2016). Cyanobacterial blooms. Ecology, prevention, mitigation and control: Editorial to a CYANOCOST Special Issue. Aquat. Ecol. 50, 327-331.
3. Huisman, J., Codd, G.A., Paerl, H.W., et al. (2018). Cyanobacterial blooms. Nat. Rev. Microbiol. 16, 471-483.
4. Wilhelm, S.W., Bullerjahn, G.S. and McKayc, R.M.L. (2020). The complicated and confusing ecology of Microcystis blooms. mBio 11, e00529-20.
5. Zhao, X., Liu, Y., Guo, Y.M., et al. (2023). Meta-analysis reveals cyanotoxins risk across African inland waters. J. Hazard. Mat. 451, 131160.
6. Jilbert, T., Couture, R.M., Huser, B.J., et al. (2020). Preface: Restoration of eutrophic lakes: current practices and future challenges. Hydrobiologia 847, 4343-4357.
7. Xie, L.Q., Xie, P., Guo, L.G., et al. (2005). Organ distribution and bioaccumulation of microcystins in freshwater fish at different trophic levels from the eutrophic Lake Chaohu, China. Environ. Toxicol. 20, 293-300.
8. Chen, J., Xie, P., Guo, L.G., et al. (2005). Tissue distributions and seasonal dynamics of the hepatotoxic microcystins-LR and -RR in a freshwater nail (Bellamya aeruginosa) from a large shallow, eutrophic lake of the subtropical China. Environ. Pollut. 134, 423-430.
9. Chen, J. and Xie, P. (2005). Tissue distributions and seasonal dynamics of the hepatotoxic microcystins-LR and -RR in two freshwater shrimps, Palaemon modestus and Macrobrachium nipponensis, from a large shallow, eutrophic lake of the subtropical China. Toxicon 45, 615-625.
10. Jeppesen, E., Søndergaard, M., Lauridsen, T.L., et al. (2012). Biomanipulation as a restoration tool to combat eutrophication: recent advances and future challenges. Adv. Ecol. Res. 47, 411-488.
11. Zhang, D.W., Xie, P., Liu, Y., et al. (2009). Transfer, distribution and bioaccumulation of microcystins in the aquatic food web in Lake Taihu, China, with potential risks to human health. Sci. Total Environ. 407, 2191-2199.
12. Chen, J., Xie, P., Li, L., et al. (2009). First identification of the hepatotoxic microcystins in the serum of a chronically exposed human population together with indication of hepatocellular damage. Toxicol. Sci. 108, 81-89.
13. Chen, L., Chen, J., Zhang, X.Z., et al. (2016). A review of reproductive toxicity of microcystins. J. Hazard. Mat. 301, 381-399.
14. Li, Y., Chen, J., Zhao, Q., et al. (2011). A cross-sectional investigation of chronic exposure to microcystin in relationship to childhood liver damage in the Three Gorges Reservoir region, China. Environ. Health Persp. 119, 1483-1488.
15. Wang, H., Xu, C., Liu, Y., et al. (2021). From unusual suspect to serial killer: Cyanotoxins boosted by climate change may jeopardize megafauna. The Innovation 2, 100092.
16. He, J., Chen, J., Chen, F., et al. (2022). Health risks of chronic exposure to small doses of microcystins: An integrative metabolomic and biochemical study of human serum. Environ. Sci. Technol. 56, 6548-6559.
17. Chen, L., Giesy, J.P., Adamovsky, O., et al. (2021). Challenges of using blooms of Microcystis spp. in animal feeds: A comprehensive review of nutritional, toxicological and microbial health evaluation. Sci. Total Environ. 764, 142319..
18. Sun, Y.F., Guo, Y.M., Xu, C., et al. (2023). Will “air eutrophication” increase the risk of ecological threat to public health? Environ. Sci. Technol. 57, 10512-10520.
19. Xie, L.Q., Xie, P., Li, S.X., et al. (2003). The low TN: TP ratio, a cause or a result of Microcystis blooms? Wat. Res. 37, 2073-2080.
20. Triest, L., Stiers, I. and van Onsem, S. (2016). Biomanipulation as a nature-based solution to reduce cyanobacterial blooms. Aquat. Ecol. 50, 461-483.
21. Xie, P. and Liu, J.K. (2001). Practical success of biomanipulation using filter-feeding fish to control cyanobacteria blooms: A synthesis of decades of research and application in a subtropical hypereutrophic lake. Sci. World J. 1, 276487.
22. 谢平,陈隽,刘佳睿(2023)非经典生物操纵驱动从水华向非水华的稳态转化——来自武汉东湖的全湖验证实验. 湖泊科学35, 1-11.
23. Xie, L.Q., Xie, P. and Tang, H.J. (2003). Enhancement of dissolved phosphorus release from sediment to lake water by Microcystis blooms - an enclosure experiment in a hyper-eutrophic, subtropical Chinese lake. Environ. Pollut. 122, 391-399.
24. Xie, P. (2006). Biological mechanisms driving the seasonal changes in the internal loading of phosphorus in shallow lakes. Sci China: D Earth Sci. 49(Supp.I), 14-27.
25. Jeppesen, E., Meerhoff, M., Jacobsen, B.A., et al. (2007). Restoration of shallow lakes by nutrient control and biomanipulation—the successful strategy varies with lake size and climate. Hydrobiologia 581, 269-285.
26. Qin, B., Deng, J., Shi, K., et al. (2021). Extreme climate anomalies enhancing cyanobacterial blooms in eutrophic Lake Taihu, China. Water Resour. Res. 57, e2020WR029371.
27. Shapiro, J., Lamarra, V. and Lynch, M. (1975). Biomanipulation: an ecosystem approach to lake restoration. In: Brezonik, P.L. & Fox, J.L. (eds.) Proceedings of a Symposium on Water Quality Management through Biological Control. University of Florida, Gainesville, pp. 85-89.
28. Zhang, X., Xie, P. and Huang, X. (2008). A review of nontraditional biomanipulation, Sci. World J. 8, 1184-1196.
29. DeMelo, R., Fracne, R. and McQueen, D.J. (1992). Biomanipulation: Hit or myth? Limnol. Oceanogr. 37, 192-207.
30. Hansson, L.A., Annadotter, H., Bergman, E., et al. (1998). Biomanipulation as an application of food-chain theory: constraints, synthesis, and recommendations for temperate lakes. Ecosystems 1, 558-574.
31. Drenner, R. and Hambright, K.D. (1999). Review: Biomanipulation of fish assemblages as a lake restoration technique. Arch. Hydrobiol. 146, 129-165.
32. Mehner, T., Benndorf, J., Kasprzak, P., et al. (2002). Biomanipulation of lake ecosystems: successful applications and expanding complexity in the underlying science. Freshwat. Biol. 47, 2453-2465.
33. Bernes, C., Carpenter, S.R. and Gårdmark, A. (2016). What is the influence of a reduction of planktivorous and benthivorous fish on water quality in temperate eutrophic lakes? A systematic review. Environ. Evid. 4, 7.
34. Kaur, S. (2020). Bio-manipulation: A restoration tool for eutrophied lakes. IJFBS 7, 1-4.
35. Paul, B., Purkayastha, K.D., Bhattacharya, S., et al. (2022). Eco-bioengineering tools in ecohydrological assessment of eutrophic water bodies. Ecotoxicology 31, 581-601.
36. Straskraba, M. (1965). The effect of fish on the number of invertebrate in ponds and streams. Mitt. Int. Ver. Limnol. 13, 106-127.
37. Gophen, M. (1990). Biomanipulation: retrospective and future development. Hydrobiologia 200/201, 1-11.
38. Hrbacek, J., Dvorakova, M., Korinek, V., et al. (1961). Demonstration of the effect of the fish stock on the species composition of zooplankton and the intensity of metabolism of the whole plankton assemblage. Verh. Int. Ver. Theoret. Angew. Limnol. 14, 192-195.
39. Brooks, J.L. and Dodson, S.I. (1965). Predation, body size, and composition of plankton. Science 150, 28-35.
40. Hurlbert, S.H., Zedler, J. and Fairbanks, D. (1972). Ecosystem alteration by mosquitofish (Gambusia affinis) predation. Science 175, 639-641.
41. Shapiro, J. (1990). Biomanipulation: the next phase – making it stable. Hydrobiologia 200/201: 13-27.
42. Kasprzak, P., Benndorf, T., Mehner, T., et al. (2002). Biomanipulation of lake ecosystems: an introduction. Freshwat. Biol. 47, 2277-2281.
43. Su, H., Wang, R., Feng, Y., et al. (2021). Long-term empirical evidence, early warning signals and multiple drivers of regime shifts in a lake ecosystem. J. Ecol. 109, 3182-3194.
44. Su, H., Feng, Y., Chen, J.F., et al. (2021). Determinants of trophic cascade strength in freshwater ecosystems: a global analysis. Ecology 102, e03370.
45. Wetzel, R.G. (2001). Limnology: Lake and River Ecosystems (Third Edition), Elsevier.
46. Shapiro, J. and Wright, D.I. (1984). Lake restoration by biomanipulation: Round Lake, Minnesota, the first two years. Freshwat. Biol. 14, 371-383.
47. Drenner, R. and Hambright, K.D. (2002). Piscivores, trophic cascades, and lake management. Sci World J. 2, 284-307.
48. Mcqueen, D.J. (1990). Manipulating lake community structure: where do we go from here? Freshwat. Biol. 23, 613-620.
49. Mcqueen, D.J. (1998). Freshwater food web biomanipulation: A powerful tool for water quality improvement, but maintenance is required. Lakes Reserv. Res. Manag. 3, 83-94.
50. Salonen, K., Sarvala, J., Horppila, J., et al. (2020). Development of Lake Vesijarvi through four decades of remediation efforts. Hydrobiologia 847, 4601-4619.
51. Nandini, S. and Sarma, S.S.S. (2023). Experimental studies on zooplankton-toxic cyanobacteria interactions: a review. Toxics 11, 176.
52. Burn, C.W. (1968). The relationship between body size of filter-feeding Cladocera and the maximum size of particle ingested. Limnol. Oceanogr. 13, 675-678.
53. Gliwicz, Z.M. (1977). Food size selection and seasonal succession of filter feeding zooplankton in an eutrophic lake. Ekol. Pol. 25, 179-225.
54. Geller, W. and Müller, H. (1981). The filtration apparatus of Cladocera: filter mesh-sizes and their implications of food selectivity. Oecologia 49, 316-321.
55. Hanson, M.A. and Butler, M.G. (1994). Responses of plankton, turbidity, and macrophytes to biomanipulation in a shallow prairie lake. Can. J. Fish. Aquat. Sci. 51, 1180-1188.
56. Dawidowicz, P., Prejs A., Engelmayer, A., et al. (2002). Hypolimnetic anoxia hampers top-down food-web manipulation in a eutrophic lake. Freshwat. Biol. 47, 2401-2409.
57. Guo, N. and Xie, P. (2006). Development of tolerance against toxic Microcystis aeruginosa in three cladocerans and the ecological implications. Environ. Pollut. 143, 513-518.
58. 刘建康, 谢平(1999)揭开武汉东湖蓝藻水华消失之谜. 长江流域资源与环境8,312-319.
59. Lazzaro, X. (1987). A review of planktivorous fishes: Their evolution, feeding behaviours, selectivities, and impacts. Hydrobiologia 146, 97-167.
60. 伍献文、饶钦止(1961)第二章 我国淡水渔业的历史. 中国淡水养鱼经验总结委员会主编,中国淡水鱼类养殖学. p. 343-380,科学出版社,北京.
61. 倪达书和蒋燮治(1954)花鲢和白鲢的食料问题. 动物学报6,59-71。
62. Xu, J. and Xie, P. (2004). Studies on the food web structure of Lake Donghu using stable carbon and nitrogen isotope ratios. J. Freshwat. Ecol. 19, 645-650.
63. Fang, P.W. (1928). Notes on the gill-rakers and their related structures of Hypophthalmichthys nobilis and H. molitrix. Contri. Biol. Lab. Sci. Soc. China 4, 1-30.
64. Voropaev, N.V. (1968). New investigations on ecology and propagation of plant feeding fish. In: Nikolskij, G.V. (ed.) Moskva, Izdat. Akad. Nauk SSSR, pp. 206-217.
65. Wilamovski, A. (1972). Structure of the gill apparatus and the suprabranchial organ of Hypophthalmichthys molitrix Val. (silver carp). Bamidgeh 24, 87-98.
66. Iwata, K. (1976). Morphological and physiological studies on the phytoplankton feeders of cyprinids: I. Developmental changes of feeding organs and ingestion rates in Kawachibura (Carassius auratus cuvieri), silver carp (Hypophthalmichthys molitrix) and Nigorobuna (C. auratus grandoculis). Jpn. J. Limnol. 37, 137-147.
67. Kajak, Z., Spodniewska, I. and Wisniewski, R.J. (1977). Studies on food selectivity of silver carp, Hypophthalmichthys molitrix (Val.). Ekol. Pol. 25, 227-239.
68. Schroeder, G. (1978). Autotrophic and heterotrophic production of microorganisms in intensively-manured fish ponds, and related fish yields. Aquaculture 14, 303-325.
69. Cremer, M.C. and Smitherman, R.O. (1980). Food habits and growth of silver and bighead carp in cages and ponds. Aquaculture 20, 57-64.
70. 刘焕亮(1981) 鲢、鳙的滤食器官. 大连水产学院学报 1, 13-33.
71. Hampl, A., Jirasek, J. and Sirotek, D. (1983). Growth morphology of the filtering apparatus of silver carp (Hypophthalmichthys molitrix): II. Microscopic anatomy. Aquaculture 31, 153-158.
72. Spataru, P., Wohlfarth, G.W. and Hulata, G. (1983). Studies on the natural food of different fish species in intensively manured polyculture ponds. Aquaculture 35, 283-398.
73. Smith, D.W. (1989). The feeding selectivity of silver carp, Hypophthalmicthys molitrix Val. J. Fish. Biol. 34, 819-828.
74. Herodek, S., Tatrai, I., Olah, J., et al. (1989). Feeding experiments with silver carp (Hypophthalmichthys molitrix Val.) fry. Aquaculture 83, 331-344.
75. Xie, P. and Liu, J.K. (1991). Phytoplankton, especially diatoms, in the gut contents and feces of two planktivorous cyprinids – silver carp and bighead carp. In: Liu, J. (ed) Annual Report of FEBL for 1990. International Academic Publishers, Beijing, pp.31-38.
76. Xie, P. (1999). Gut contents of silver carp, Hypopthalmichthys molitrix, and the disruption of a centric diatom, Cyclotella, on passage through the esophagus and intestine. Aquaculture 180, 295-305.
77. Xie, P. (2001). Gut contents of bighead carp (Aristichthys nobilis) and the process and digestion of algal cells in the alimentary canal. Aquaculture 195, 149-161.
78. 孙晓明,孟庆闻(1992)鲢、鳙滤食及消化器官的发育、构造与食性的相互关系 水产学报16, 202-212.
79. 刘焕亮,李梦河,李立萍等(1993) 鲢滤食器官胚后发育生物学的研究.大连水产学院学报8, 1-19.
80. 王良臣,郭淑华(1994) 鲢鱼鳃的扫描电镜研究.南开大学学报(自然科学版) 1, 71-76.
81. 李德尚,董双林(1996) 鲢、鳙滤食器官结构与功能的研究.动物学报42, 10-14.
82. Voros, L., Oldal, I., Presing, M., et al. (1997). Size-selective filtration and taxon-specific digestion of plankton algae by silver carp (Hypophthalmichthys molitrix Val). Hydrobiologia 342/343, 223-228.
83. 曾青兰(2001)鲢、鳙鱼对扁裸藻消化利用的研究安. 徽农业科学29, 549-552.
84. 陆开宏,王扬才,蔡惠凤(2005)2种摄藻鱼消化酶活性及消化器官组织形态比较研究. 水利渔业. 25, 37-39.
85. Boruckij, E.V. (1973). Feeding of Hypophthalmichthys molitrix (Val,) and Aristichthys nobilis [Val,) in natural waters of Soviet Union. [Pitanie belogo (Hypophthalmichthys molitrix (Val.)) i pestrogo (Aristichthys nobilis (Val.)) tolstoiobikov v estestvennych vodoemach i prudaclr SSSR] In: Nikolskij, G.V., Piroznikov, P. L (eds.), Trofologia vodnych zivotnych. Itogi i zadaci. Izdattelstvo 'Nauka', Moskva, 299- 322.
86. Bitterlich, G. (1985). Digestive enzyme pattern of two stomachless filter feeders, silver carp, Hypophthalmichthys molitrix Val., and bighead carp, Aristichthys nobilis Rich. J. Fish Biol. 27, 103-112.
87. Moriarty, D.J.W., Darlington, J.P.E.C., Dunn, I.G., et al. (1973). Quantitative estimation of the daily ingestion of phytoplankton by Tilapia nilotica and Haplochromis nigripinnis in Lake George, Uganda. Proc. Roy. Soc. Lond. 184B, 299-319.
88. Caulton, M.S. (1976). The importance of pre-digestive food preparation to Tilapia rendalli Boulanger when feeding on aquatic macrophytes. Trans. Rhod. Sci. Assoc. 57, 22-28.
89. Payne, A.I. (1978). Gut pH and digestive strategies in estuarine grey mullet (Mugilidae) and tilapia (Cichlidae). J. Fish. Res. Board Can. 13, 627-629.
90. Bitterlich, G. (1985). The nutrition of stomachless phytoplanktivorous fish in comparison with Tilapia. Hydrobiologia 121, 173-179.
91. Savina, P.A. (1965). Filter feeding of silver carp Hypophthamichthys molitrix (Val.). [Filtracionnoe pitanie belogo tolstolobika Hypophlhalmichthys molitrix (Val.)]. Vopr. Ichtiol. 5, 135-140.
92. Malyarevskaya, A.Y.A., Birger, T.I., Arsan, O.M., et al. (1972). Metabolic relationship between blue-green algae and fish. Hydrobiol. J. 8, 35-41.
93. Vovk, P. S. (1974). The possibilities of using silver carp Hypophthalmichthys molitrix (Val.) to increase the fish productivity and to decrease the eutrophication of the Dniepr reservoirs. [O vozmoznosti ispolzovanija belogo tolstolobika (Hypophthalmichthys molitrix (Val.)) dla povysenija ryboproduktivnosti i snizenija urovnija evtrofikacii Dneprovskich vodochranilisc]. Vopr. Ikhtiol. 14, 406-414.
94. Bitterlich, G. (1985). Digestive processes in silver carp (Hypophthalmichthys molitrix) studied in vitro. Aquaculture 50, 123-131.
95. 蔡仁达,华瑶(1962)应用示踪原子研究青、草、鲢、鳙、鲤等鱼类对单细胞绿藻的消化吸收研究. 原子能科学技术3, 231-235.
96. 石志中,方德奎,张卫(1975)白鲢等鱼种对螺旋鱼腥藻消化吸收的示踪实验报告. 水生生物学集刊 6, 497-502.
97. Panov, D.A., Sorokin, Y. and Motenkova, L.G. (1969). Experimental research in the feeding of the young bighead and silver carp. Vop. Ikhtiol. 9, 138-152.
98. 石志中,方德奎,张卫(1976)白鲢鱼种摄食量和利用率的研究. 水生生物学集刊5,497-502.
99. Iwata, K. (1977). Morphological and physiological studies on the phytoplankton feeders of cyprinids. II. Developmental changes of assimilation efficiency in terms of carbon, estimated by using 14C-labeled green algae in Carassius auratus cuvieri, Hypophthhalmichthys molitrix and C. auratus grandoculis). Jpn. J. Limnol. 38, 19-32. (in Japanese with English abstract)
100. 朱蕙(1982)鱼类对藻类消化吸收的研究(I)白鲢对斜生栅藻的消化吸收. 水生生物学集刊7,547-550.
101. 朱蕙和邓文瑾(1983)鱼类对藻类消化吸收的研究(II)鲢、鳙对微囊藻和裸藻的消化吸收. 鱼类学论文集3,77-91.
102. 董双林(1992)鲢鳙鱼摄食生物学的实验研究. 博士学位论文. 青岛海洋大学.
103. Spataru, P. (1977). Gut contents of silver carp - Hypophthalmicthys molitrix (Val.) and some trophic relations to other fish species in a polyculture system. Aquaculture 11, 137-146.
104. 陈少莲, 刘肖芳(1989)鲢鳙对鱼粪消化利用的研究. 水生生物学报13,250-258.
105. 陈少莲,刘肖芳,胡传林等(1990)论鲢、鳙对微囊藻的消化利用. 水生生物学报14, 49-59.
106. Chen, J., Xie, P., Zhang, D., et al. (2006). In situ studies on the bioaccumulation of microcystins in the phytoplanktivorous silver carp (Hypophthalmichthys molitrix) stocked in Lake Taihu with dense toxic Microcystis blooms. Aquaculture 261, 1026-1038.
107. Chen, J., Xie, P., Zhang, D., et al. (2007). In situ studies on the distribution patterns and dynamics of microcystins in a biomanipulation fish - bighead carp (Aristichthys nobilis). Environ. Pollut. 147, 150-157.
108. Qiu, T., Xie, P. and Ke, Z.X. (2007). In situ studies on physiological and biochemical responses of four fishes with different trophic levels to toxic cyanobacterial blooms in a large Chinese lake. Toxicon 50, 365-376.
109. Xie, L.Q., Xie, P., Ozawa, K., et al. (2004). Dynamics of microcystins-LR and -RR in the phytoplanktivorous silver carp in a sub-chronic toxicity experiment. Environ. Pollut. 127, 431-439.
110. Chen, F., Xue, G., Wang, Y.K., et al. (2023). Evolution of the Yangtze River and its biodiversity. The Innovation 4, 100417.
111. Wang, H., Wang, P., Xu, C., et al. (2022). Can the “10-year fishing ban” rescue biodiversity of the Yangtze River? The Innovation 3, 100235.
112. 谢平(2003)鲢、鳙与藻类水华控制. 科学出版社, 北京.
113. Welcomme, R.L. (1988). International Introductions of Inland Aquatic Species. FAO Fish. Tech. Pap. vol. 294. Food and Agriculture Organization, Rome.
114. Opuszynski, K. and Shireman, J.V. (1993). Food habits, feeding behaviour and impact of triploid bighead carp, Hypophthalmichthys nobilis, in experimental ponds. J. Fish Biol. 42, 517-530.
115. Kajak, Z., Rybak, J.I., Spodniewska, I., et al. (1975). Influence of the planktonivorous fish Hypophthalmichthys molitrix (Val.) on the plankton and benthos of eutrophic lake. Pol. Arch. Hydrobiol. 22, 301-310.
116. Smith, D.W. (1985). Biological control of extensive phytoplankton growth and the enhancement of aquaculture production. Can. J. Fish. Aquat. Sci. 42, 1940-1945.
117. Januszko, M. (1974). The effect of three species of phytophagous on algae development. Pol. Arch. Hydrobiol. 21, 431-454.
118. Opuszynski, K. (1979). Silver carp, Hypophthalmichthys molitrix (Val.), in carp ponds. 3. Influence on ecosystem. Ekol. Pol. 27, 117-133.
119. Burke, J.S., Bayne, D.R. and Rea, H. (1986). Impact of silver and bighead carps on plankton communities of channel catfish ponds. Aquaculture 55, 59-68.
120. Laws, E.A. and Weisburd, R.S.J. (1990). Use of silver carp to control algal biomass in aquaculture ponds. Prog. Fish-Cult. 52, 1-8.
121. Starling, F.L.R.M. and Rocha, A.J.A. (1990). Experimental study of the impacts of planktivorous fishes on plankton community and eutrophication of a tropical Brazilian reservoir. Hydrobiologia 200/201, 581-591.
122. Xie, P. and Liu, J.K. (1992). Studies on the influence of planktivorous fishes (silver carp and bighead carp) on the “water bloom” in a shallow, eutrophic Chinese lake (Lake Donghu) using enclosure method. FEBL Annual Report for 1991. Beijing: International Academic Publishers 21-24.
123. Xie, P., Wang, S., Wang, J., et al. (1993). An enclosure experiment on the influence of three “domestic” carps, silver carp, bighead carp and grass carp, on the “water bloom” in a shallow, eutrophic Chinese lake (Lake Donghu). FEBL Annual Report for l992. Beijing: International Academic Publishers 13- 20.
124. Xie, P. (1996). Experimental studies on the role of planktivorous fishes in the elimination of Microcystis bloom from Donghu Lake using enclosure method. Chin. J. Oceanol. Limnol. 14, 193-204.
125. 李琪,李德尚,熊邦喜等(1993)放养鲢鱼(Hypophthalmichys mdlitrix C et V)对水库围隔浮游生物群落的影响. 生态学报 13, 30-37.
126. Starling, F., Beveridge, M., Lazzaro, X., et al. (1998). Silver carp biomass effects on the plankton community in Paranoá Reservoir (Brazil) and an assessment of its potential for improving water quality in lacustrine environments. Int. Rev. Hydrobiol. 83, 499-507.
127. Datta, S. and Jana, B.B. (1998). Control of bloom in a tropical lake: grazing efficiency of some herbivorous fishes. J. Fish Biol. 53, 12-24.
128. 王海珍,刘永定,肖邦定等(2004)围隔中鲢和菹草控藻效果及其生态学意义. 水生生物学报28,141-146.
129. Zhang, X., Xie, P., Hao, L., et al. (2006). Effects of the phytoplanktivorous silver carp (Hypophthalmichthys molitrix) on plankton and the hepatotoxic microcystins in an enclosure experiment in a eutrophic lake, Lake Shichahai in Beijing. Aquaculture 257, 173-186.
130. 胡秀琳,廖日红,孟庆义等(2007)鲢鱼放养控制北京城市河湖水华试验研究. 环境工程学报1,30-35.
131. 蔡建楠,潘伟斌,王建华等(2008) 鲢和奥尼罗非鱼对池塘蓝藻水华及水质的影响. 水生态学杂志 1, 56-61.
132. Xiao, L., Ouyang, H., Li, H., et al. (2010). Enclosure study on phytoplankton response to stocking of silver carp (Hypophthalmichthys molitrix) in a eutrophic tropical reservoir in south China. Internat. Rev. Hydrobiol. 95, 428-439.
133. 王嵩,王启山,张丽彬等(2009)水库大型围隔放养鲢鱼、鳙鱼控藻的研究. 中国环境科学29,1190-1195.
134. 王丽卿,许莉 陈庆江等(2011)鲢鳙放养水平对淀山湖浮游植物群落影响的围隔实验. 环境工程学报5,1790-1795.
135. Yin, C., Guo, L., Yi, C., et al. (2017). Physicochemical process, crustacean, and Microcystis biomass changes in situ enclosure after introduction of silver carp at Meiliang Bay, Lake Taihu. Scientifica 17, 9643234.
136. Yi, C., Guo, L. and Ni, L. (2016). Silver carp exhibited an enhanced ability of biomanipulation to control cyanobacteria bloom compared to bighead carp in hypereutrophic Lake Taihu mesocosms. Ecol. Eng. 89, 7-13.
137. 杨璇,苏玉萍,张玉珍等(2013)塘坂水库春季养鱼控藻围隔试验研究. 亚热带资源与环境学报8,25-30.
138. 苏玉萍,李赫龙,张玉珍等(2016)山仔水库不同季节围隔放鱼控藻效果研究. 福建师范大学学报(自然科学版)32,47-55.
139. 靳晓彤,唐雅丽,郭佳等(2023) 不同体型大小的鲢对富营养化水体中浮游植物的影响. 生态科学42, 98-105.
140. Domaizon, I. and Devaux, J. (1999). Experimental study of the impacts of silver carp on plankton communities of eutrophic Villerest reservoir (France). Aqu. Ecol. 33, 193-204.
141. 崔福义,林涛,马放等(2004) 水体治理中鲢鳙生物操纵作用的实验研究. 南京理工大学学报(自然科学版) 28, 668-672.
142. 郎宇鹏,朱 琳,刘春光等. 2006. 鲢鱼对淡水浮游植物的抑制作用研究. 农业环境科学学报25(增刊): 683- 686.
143. 林海,周刚,张彤晴等(2009) 室内水生动物对蓝藻生长的抑制效果. 江苏农业学报25, 685-688.
144. 郭艳敏,高月香,张毅敏等(2016)鲴对食微囊藻鲢鳙排泄物及藻活性的作用研究. 中国环境科学36,3784-3792.
145. 陈玲玲,高月香,张毅敏等(2019)鲢鱅鲴混养对水环境及氮素迁移转化的影响.中国环境科学39, 1181-1188.
146. Shen, R., Gu, X., Chen, H., et al. (2020). Combining bivalve (Corbicula fluminea) and filter-feeding fish (Aristichthys nobilis) enhances the bioremediation effect of algae: an outdoor mesocosm study. Sci Total Environ. 727, 138692.
147. Zhang, Y., Shen, R., Li, K., et al. (2023). Top-down effects of filter-feeding fish and bivalves moderate bottom-up effects of nutrients on phytoplankton in subtropical shallow lakes: An outdoor mesocosm study. Eco. Evol. 13, e1056.
148. 梁晓霞,严花,韩强等(2008) 白鲢鱼对水体浮游藻类多样性及水质的影响研究.山西大学学报(自然科学版) 31 (S2), 113-117.
149. Zhang, Z., Shi, Y. and Zhang, J. (2022). Experimental observation on the effects of bighead carp (Hypophthalmichthys nobilis) on the plankton and water quality in ponds. Environ. Sci. Pollut. Res. 29, 56658-56675.
150. 胡忠军,张婧雯,张真等(2021)不同鲢密度对千岛湖沿岸池塘浮游植物群落结构的影响. 水生态学杂志42,57-63.
151. 孙龙生,沈勇,杨祎擎等(2019) 放养不同数量白鲢对罗氏沼虾池塘蓝藻水华及水质的影响. 水产养殖 40, 48-52.
152. 唐洪玉,苏胜齐姚维志(2003))鳞和长刺搔与浮游植物相互作用关系研究. 西南农业大学学报 25, 451-455.
153. 韩士群,范成新,严少华(2006)S滩涂富营养池塘中浮游生物种群结构及其生态调控研究. 水生生物学报30, 344-348.
154. Shen, R., Gu, X., Chen, H., et al. (2021). Silver carp (Hypophthalmichthys molitrix) stocking promotes phytoplankton growth by suppression of zooplankton rather than through nutrient recycling: An outdoor mesocosm study. Freshwat. Biol. 66, 1074-1088.
155. 马华,崔福义,范振强等(2012)净水厂处理前端放养鲢鱼对藻类的去除特性及相关因素研究. 城镇给排水38,34-38.
156. 范振强,崔福义,马华等(2008)放养鲢鱼预处理高藻原水的除藻效能及特性. 环境科学29,632-637.
157. 马华,崔福义,刘志泉等(2009)鲢鱼联合常规水处理工艺除藻特性. 环境科学学报29,2519-2524.
158. 贾柏樱,马 华(2017)生物操纵技术控制原水藻类的应用研究. 中国给排水33,11-15.
159. Ke, Z.X., Xie, P., Guo, L., et al. (2007). In situ study on the control of toxic Microcystis blooms using phytoplanktivorous fish in the subtropical Lake Taihu of China: A large fish pen experiment. Aquaculture 165, 127-138.
160. Xie, L.Q. and Xie, P. (2022). Long-term (1956–1999) dynamics of phosphorus in a shallow, subtropical Chinese lake with the possible effects of cyanobacterial blooms. Wat. Res. 36, 343-349.
161. 曾庆飞,谷孝鸿,毛志刚等(2010) 鲢鳙控藻排泄物生态效应研究进展. 生态学杂志29, 1806-1811.
162. 王银平,谷孝鸿,曾庆飞等(2014)控( 微囊) 藻鲢、鳙排泄物光能与生长活性. 生态学报34, 1707-1715.
163. 王银平,谷孝鸿,曾庆飞等(2015) 食微囊藻干粉鱼类对水环境的影响及氮素迁移转化规律. 湖泊科学27, 475-485.
164. Mao, Z., Gu, X., Gao, Y., et al. (2020). The role of top-down and bottom-up control for phytoplankton in a subtropical shallow eutrophic lake: evidence based on long-term monitoring and modeling. Ecosystems 23, 1449-1463.
165. 谷孝鸿,李红敏,毛志刚等(2021)蓝藻水华与淡水鱼类的生态相互作用研究进展. 科学通报 66, 2649-2662.
166. 史小丽,杨瑾晟,陈开宁等(2022)湖泊蓝藻水华防控方法综述. 湖泊科学 34, 349-375.
167. Opuszynski, K. (1978). The influence of silver carp (Hypophthalmichthys molitrix) on eutrophication of the environment of carp ponds. VII. Recapitulation. Rocn. Nauk Roln. Ser. H99, 127-149.
168. 肖新宗,田娜娜,邢明星等(2023) 鲢鲴混养对水体环境的影响. 生物资源45, 108-116.
169. Lazareva, L.P., Omarov, M.O. and Lezina, A.N. (1977). Feeding and growth of the bighead, Aristichthys nobilis, in the waters of Dagestan. J. Ichthyol. 17, 65-75.
170. Ke, Z.X., Xie, P. and Guo, L.G. (2008). In situ study on effect of food competition on diet shifts and growth of silver and bighead carps in large biomanipulation fish pens in Meiliang Bay, Lake Taihu. J. Appl. Ichthyol. 24, 263-268.
171. Chiang, W. (1971). Studies on feeding and protein digestibility of silver carp, Hypophthalmichthys molitrix (C & V.). Jt. Comm. Reconstr. Fish. Seres 11, 95-114.
172. Iwata, K. (1976). Morphological and physiological studies on the phytoplankton feeders of cyprinids: II. Developmental changes of assimilation efficiency in terms of carbon, estimated by using 14C-labeled green algae in Carassius auratus cuvieri, Hypophthalmichthys molitrix and C. auratus grandoculis. Jpn. J. Limnol. 38, 19-32.
173. Opuszynski, K., Shireman, J.V. and Cichra, C.E. (1991). Food assimilation and filtering rate of bighead carp kept in cages. Hydrobiologia 220, 49-56.
174. Dong, S. and Li, D. (1994). Comparative studies on the feeding capacity of silver carp (Hypophalmichthy mo1itrix) and bighead carp (Aristichthys nobilis). Oceanol. Limnol. Sinica 12, 185-190.
175. 牟洪民,姚俊杰,方贵等(2012) 贵阳红枫湖鲢、鳙的食性研究. 淡水渔业42, 44-49.
176. 李倩倩,黄鹤忠,张群英等(2013) 东太湖不同水域浮游生物周年变化及鲢、鳙食性的研究海洋科学37, 104-110.
177. Chen, F., Smith, C., Wang, Y.K., et al. (2021) The evolution of alternative buoyancy mechanisms in freshwater fish eggs. Front. Ecol. Evol. 9, 736718
178. Chen, F., Wang, Y.K., He, J., et al. (2022) Molecular mechanisms of spawning habits for the adaptive radiation of endemic East Asian cyprinid fishes. Research 2022, 9827986.
179. Wang, Y.K., Chen, F., He, J., et al. (2022) Comparative ultrastructure and proteomics of two economic species (common carp and grass carp) egg envelope. Aquaculture 546, 737276.
180. Jeppesen, E., Kronvang, B., Meerhoff, M., et al. (2009). Climate change effects on runoff, catchment phosphorus loading and lake ecological state, and potential adaptations. J. Environ. Quality 38, 1930-1941.
181. Chick, J.H. and Pegg, M.A. (2001) Invasive carp in the Mississippi River Basin. Science 292, 2250-2251.
182. Xie, P., Chen, Y. (2001) Invasive carp in China's plateau lakes. Science 294, 999-1000.
183. Harris, B.S., DeBoer, J.A. and Lamer, J.T. (2020) Trophic reorganization of native planktivorous fishes at different density extremes of bigheaded carps in the Illinois and Mississippi rivers, USA. Biol. Invasions 24, 3013-3031.
184. Kibuye, F.A., Zamyadi, A. and Wert, E.C. (2021) A critical review on operation and performance of source water control strategies for cyanobacterial blooms: Part II-mechanical and biological control methods. Harmful Algae 109, 102119.
185. Su, H., Chen, J., Li, Y., et al. (2022). Carp stocking and climate change are potentially more important factors than nutrient enrichment driving water quality deterioration in subtropical freshwater lakes in China. Limnol. Oceanogr. 68, S131-S143.
186. Zhang, Y., Shen, R., Gu, X.H., et al. (2023) Simultaneous increases of filter-feeding fish and bivalves are key for controlling cyanobacterial blooms in a shallow eutrophic lake. Wat. Res. 245, 120579.
本文的引用方式:
Chen J., Liu J., Han S. et al. (2023). Nontraditional biomanipulation: A powerful ecotechnology to combat cyanobacterial blooms in eutrophic freshwaters. The Innovation Life 1 (3), 100038. https://doi.org/10.59717/j.xinn-life.2023.100038
或者:
Chen J., Liu J., Han S., Su H., Xia W., Wang H., Liu Y., Zhang L., Ke Z., Zhang X., Tang H., Shen H., Tao M., Shi P., Zhang W., Wang H., Zhang J., Chen Y., Rao Q., Rao X., Xie L., Chen F., Deng X., Fan X., He J., Chen L., Xu J. and Xie P. (2023). Nontraditional biomanipulation: A powerful ecotechnology to combat cyanobacterial blooms in eutrophic freshwaters. The Innovation Life 1 (3), 100038. https://doi.org/10.59717/j.xinn-life.2023.100038
原文pdf(中英文)
![]() 非经典生物操纵(Chen et al. 2003 The Innovation Life 1, 100038).pdf
非经典生物操纵(Chen et al. 2003 The Innovation Life 1, 100038).pdf
![]() Nontraditional biomanipulation (Chen et al. 2023 The Innovation Life 1, 100038).pdf
Nontraditional biomanipulation (Chen et al. 2023 The Innovation Life 1, 100038).pdf
https://blog.sciencenet.cn/blog-1475614-1411650.html
上一篇:“空气富营养化”给人类健康带来新威胁
下一篇:一个基于宏演化证据的真核生物起源新理论——DNA压缩假说(The DNA Packing Hypothesis)