博文
元素周期表年话元素与周期(四)
|
元素周期表年话元素与周期(四)
--氮、氧、氟、氖
核结构是原子空间结构的基础,电子趋向于运动在与质子对应的低势能区域。核结构来自核子的对称、相间分布,元素周期性最终来自原子核中质子的周期分布。这样得到的电子空间分布,用配对规则就可以解析原子间的主要凝聚过程。
——元中科技理论组的基本观点

氮、氧元素核结构中两侧各三个质子,对称分布。氮原子核的中部一个质子,氧原子核的中部两个质子。稳定核素中两侧六个PN结团均以中子与内部结合,形成相间分布,同侧的三个质子互相排斥,互相影响,质子间无各自清晰的界限。
与之对应的3个电子一起在环形空间运动。氮原子中部1个电子,氧原子中部2个电子。氮核中部一个质子对两侧的作用相对比较弱,相对氧核,质子分布得比较松散,同侧质子间的相互作用也相对(氧)比较小。所以同侧的三个电子每个都有很大概率运动在各自的区域,同时又存在一定的概率运动在共同的环形区域。而氧原子核中同侧三个质子的相互作用比较大,外围三个电子主要在共同环形区域运动。这就决定了氮原子可以得到电子,也可以失去电子;而氧原子具有得到两个电子的强烈趋势。
从上面氮与氧元素的分析可以推导出电子运动状态与质子关系极其密切。
氟、氖元素的核结构中两侧各四个质子对称分布,氟原子核的中部一个质子,氖原子核的中部两个质子。氟、氖元素的核结构中两侧八个PN结团均以中子与内部形成相间的结合,四个中子与内部的质子直接相互作用,成为内外质子联系的纽带,结构紧密而稳定。每侧四个电子运动在环形区域。氟原子的中部仅一个电子,中部的势能非常低。
从3号元素开始,原子中的质子、电子都可以分为三个部分:Li(1、1、1)、Be(1、2、1)B(2、1、2)、C(2、2、2)、N(3、1、3)、O (3、2、3)、F(4、1、4)、Ne(4、2、4)。简图如下:
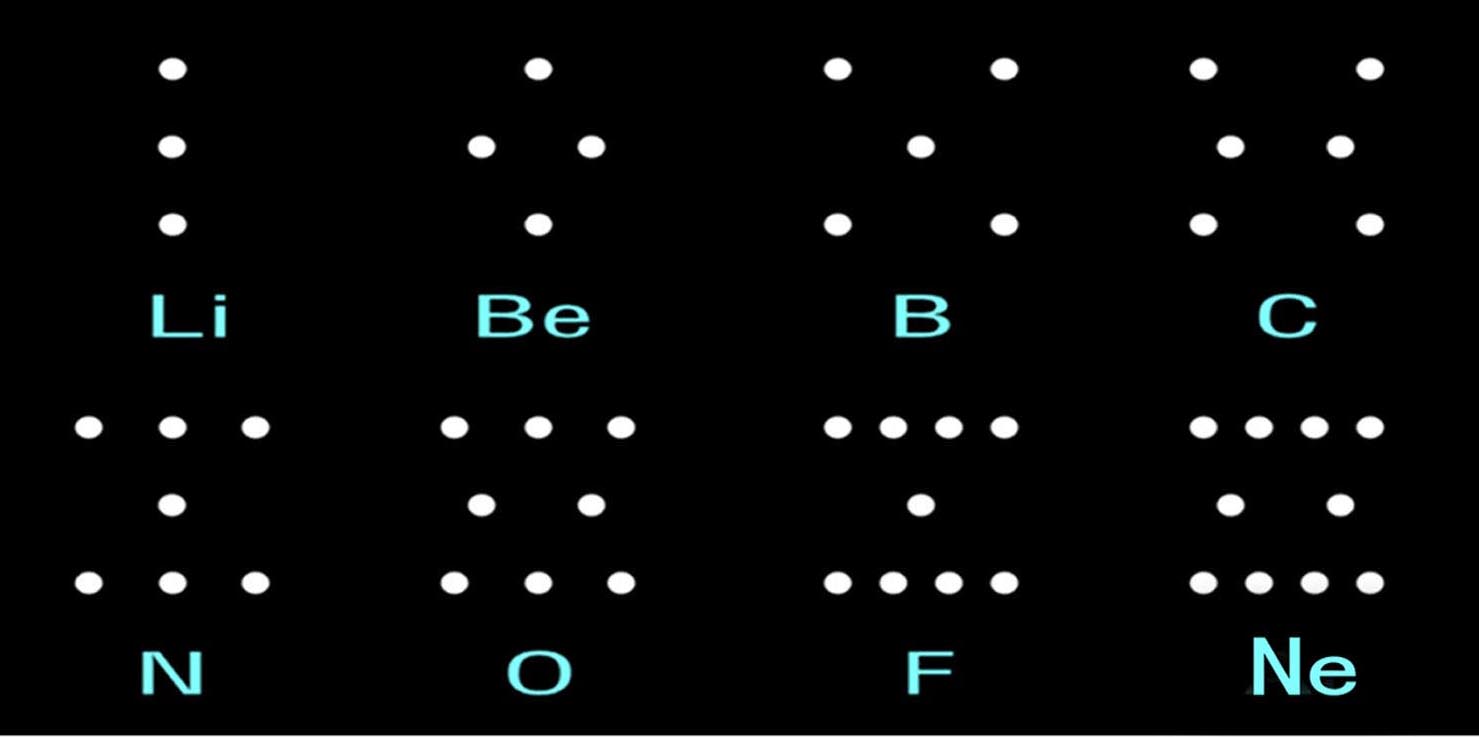
这样的电子分布有什么用呢?可以分析原子间地凝聚!并且比较自然!
同一区域内的电子相互间直接相互作用,电子数只有达到2或2的倍数时,电子的空间运动状态才能平衡。因此仅仅需要配对原则即可解析原子间的主要凝聚过程。
比如HF与BN:
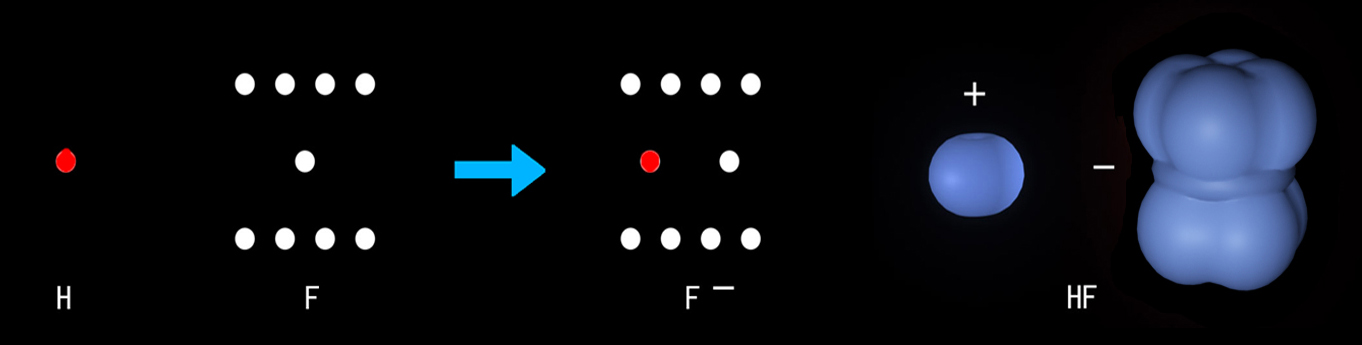
F原子两侧有四个电子,这两个区域的电子空间运动状态已经平衡,中部仅一个电子,属于开放的空间状态,同时具有极低的空间结构势能,因此具有很强地接受一个电子的趋势。因此氢原子的电子非常易于被氟原子中部得到,形成HF。
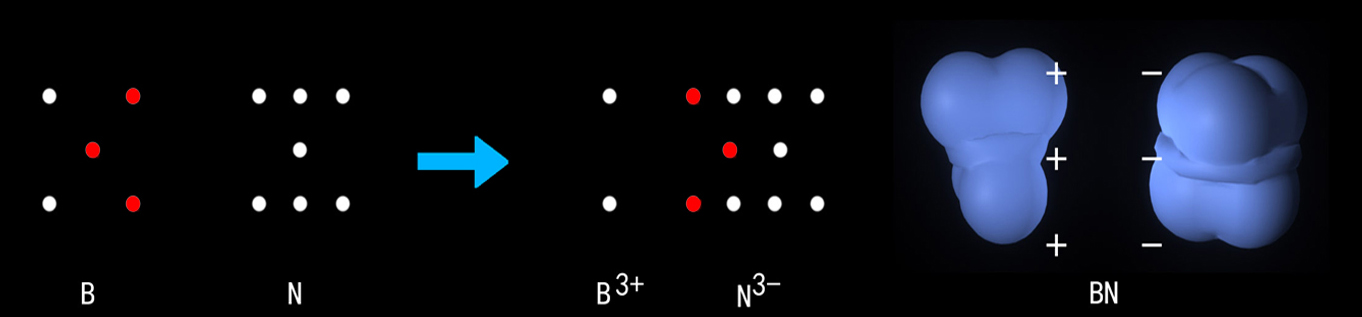
B原子中部一个孤立的电子,两端各两个孤立的电子,共五个孤立的电子分别运动在各自的正电态区域;N原子中部一个孤立电子,两端各三个电子运动在同一区域,它们的三个部分都需要电子,两个元素的原子可以从三个部位互相结合。这个组合中的硼原子还有两单电子需要配对,因此可以结合其他原子及组合,因此BN所形成的固体硬度、溶沸点都比较高。
待续,模型仍处于草创初级阶段,定有诸多不足之处,非常期待您的宝贵意见与建议!
https://blog.sciencenet.cn/blog-779581-1209372.html
上一篇:元素周期表年话元素与周期(三)
下一篇:时空弯曲会发生在那里?