博文
Discovery of cGAS-STING pathway
 精选
精选
|
cGAS-STING通路的发现之旅
自上次稍稍搜索了一番HBV和STING之间的关联,我突然对这条通路很感兴趣,业余的时间总忍不住想看看这条通路是如何被发现的。很巧,看到一篇“ZheMa(University of North Carolina at Chapel Hill)”写的综述文章,直觉告诉我:他有可能是我实验室的师兄。就像去年看到一篇文章的作者中有“Hongyan Guo,Emory University”我一眼看出她就是小郭!话不多说,简而言之,这条通路可感知细胞质内的DNA,并且无需免疫细胞的传递或间接的调节,可直接影响IFN的表达,还有一点是该通路直接和机体的先天性免疫相关,和癌症、病毒感染、免疫性疾病等有直接关联。
至此还是有很多老问题:该通路如何发现的?为何没有更早的被挖掘?与免疫有何紧密关系?目前研究热点是什么?和药物研发有何关系?研究技术和方法有哪些?其中有哪些有趣的故事?还有哪些猜测没有被证实?等等。故事就是这样,若是对此一无所知,也就无法产生兴趣;若是对之一知半解,却又无用;唯有专注一段时间,才会触及奥妙的边缘,让你好奇万分。曾经公司内部的一门课“Career development”中CSO提及了读书的三境界,几次课都反复强调:
Understand the conclusion,without knowing the reason;--A book slaver
Understand the conclusion, knowingthe reason;
Understand the conclusion, knowingits limits;--A book owner
我感觉自己所追求的也是提高自己读书的境界,我不希望自己只是知道一些知识,听说过一些内容,目前我的阶段性目的是了解问题的背后和未来,希望自己能提出前沿的问题并给出解决方案。但也有一个限制:我只对自己感兴趣的言语、话题、新闻稍稍上点心,大多时候对文字免疫,无法刺激我的神经,在我的脑中未曾留下片刻足迹。
——题记
过去的十多年人们围绕细胞质DNA与免疫刺激因子开展了许多创新性的研究,自2008年起诸多的DNA sensor被相继发现,并且进一步解释了DNA诱导I型IFN的表达、抗病毒效应以及自身免疫等现象的分子机制。至今人们已发现十余种DNSsensor,在他们的下游有一个关键的分子——STING,作为枢纽向下继续传递信号。容我徐徐道来其中的细节。
Immune Sensing of DNA
先天免疫,换句话说就是本身具有的免疫,与针对特异抗原产生特异性的抗体和活化T细胞有着明显的不同,他能过通过某种方式直接识别“外来物”并活化免疫系统对之加以攻击。与军事上的应急处理方式类似,未及中央给予回复便可适时反击。很早以前人们发现了先天免疫会利用一种天生的受体,俗称模式识别受体(patternrecognize receptors, PPRs),这些受体可以识别一些非自我、来自病原生物的产物(也称病原相关分子模式,pathogen-associatedmolecular patterns, PAMPs)或带有自我伤害性质的宿主分子(damage-associatedmolecular patterns, DAMPs),之后激活自身免疫系统来清除外来物或者对自身有损害的分子。最早被发现的、也是被研究最为透彻的就是Toll样受体(Toll-like receptors, TLRs。TLRs表达在细胞表面或是内体膜上,以便识别细胞外和细胞内的PAMPs或DAMPs。
在2006年到2012年间,人们报道了PRRs可以识别细胞质内和细胞核内的部分核酸。注意:是核酸!我估摸早期人们认为抗原主要应该是外来物的一些特别的成分,也就是宿主细胞没有的成分,比如微生物的LPS,蛋白等,可核酸,大千世界都(几乎)一样啊!如何区分敌我呢?随即这个新发现好比一块石头,“噗通”一声跳入平静的水面,人们感知到先天性免疫即将发生革命性的转变。(现在看来,和CRIPSR/Cas9又一次惊人的相似:核酸竟然可以靶向编辑基因组?竟然除了DNA结合蛋白意外,核酸也可以哦!)接下来人们陆续揭示了细胞内DNAsensor,相继阐明介导免疫系统应答的分子机制,发现DNA可以诱导I型IFN的表达、炎症因子的释放,引发自噬、凋亡、焦亡等过程。[1]
那么问题来了:细胞质中的DNA 哪里来的?与“良民”有何区别?细胞如何识别?
其实对于外源DNA能刺激机体免疫水平的了解早在1960s就开始,稍稍想象一下当时发现DNA是遗传物质不久,当时的研究手段不乏排除法,比如发现病毒能诱导细胞产生IFNs后开始研究直接的刺激因子,是蛋白组分呢?DNA还是RNA?等等,A. Isaacs等人早期的探索揭示了外源的核酸可以诱导IFN的表达。[2]现在我们会说真核细胞中的DNA长居于细胞核中,因此会认为不老实的DNA是破坏分子,若DNA悄然来到细胞质、内体等地方,细胞绝对不允许。(可,真的如此吗?那么原核细胞中的DNA又是如何存活的呢?难道细菌内部没有DNAsensor?先把疑问放在这儿)。由此看你来,细胞核获得了胞内免疫的某种特权,内部的DNA被视为良民,而细胞核以外的DNA则会被格杀勿论,被贴上DNA PAMPs或DNA DAMPs的标签。其实,外源的DNA确实有些不一样,比如无甲基化的CpG DNA模序(unmethylatedCpG DNA motifs)常见于病原体的基因组、富含AT环结构的单链DNA等。
谈到细胞如何识别核酸就会让人想到OAS(2’5’-oligoadenylatesynthase)和cGAS(cyclic GMP-AMPsynthase)、 TLR和STING。我想这里主要的发现依然是来自人们对病毒的研究,病毒来源的核酸会被一些特别的模序(motif)识别或感知,比如未经修饰的完全互补的5’三磷酸的RNA(unmodified full base-paired 5’-triphosphorylated RNAs, 5’PPP-RNA)可活化细胞内的RNA解旋酶RIG-I(retinoicacid-inducible gene I)、长链的RNA可被MDA5(melanoma differentiation-associated gene 5 )检测,而TLRs可以识别多种RNA和DNA分子。[3]

The three mammalian RLRs are superfamily 2 DExD/H-box RNA helicases[3]
OAS和cGAS的名称看似姊妹,实际上二者也有许多共性,但分工不同。简单来说,OAS可以感知细胞质中的RNA,而cGAS可感知细胞质中的DNA。其中cGAS通过典型的PRR的通路被激活,通过STING上调IFNs的表达,进而诱发抗病毒的活性;与之不同,OAS和下游的RNase L一同触发更为激烈、及时的反应来降解病毒的RNA,抑制病毒蛋白的翻译。OAS和cGAS在结构上有类似的折叠,或许进化与同一起点;二者结合双链核酸的方式类似;都产生2’5’相的磷酸二酯键;二者实属同一个大的家族,称为核苷酸转移酶(nucleotidyltransferase)。
The OAS-RNase L system
正如其名,OAS可以产生2’5’相连的寡聚腺苷酸(2’5’-linkedoligoadenylates, 2'-5'A),在人源细胞中存在四个同源的蛋白:OAS1、OAS2、OAS3和OASL(OAS like protein),前三者可以产生2’-5’A,OASL缺乏这种能力,但有报道显示他可以通过RIG-I发挥抗病毒的功能。之后2’-5’A作为第二信使会通过诱导RNase L二聚化并使其活化。RNase L是细胞质内的一种核酸酶,又称RibonucleaseL、ribonuclease 4 或OAS-dependentribonuclease,可直接切割细胞内源的或病毒的RNA,进而抑制病毒的复制;RNaseL也是一种可被IFN诱导表达的一种蛋白,可以通过MDA5诱导IFN的表达,上调OAS的表达后来增强抗病毒的活性。细胞十分危急时刻,也会选择宁为玉碎不为瓦全的手段摧毁病毒的感染。当细胞内病毒的RNA过量时,RNase L的长时间活化也会破坏细胞本身的正常运转,抑制细胞蛋白的表达、诱发凋亡,阻止病毒的进一步增殖。

RNase L activation pathway (From Wikipedia)
TLR9
早期人们发现细菌的DNA可以活化哺乳类动物的免疫细胞,主要由于细菌的DNA存在未经修饰的CpG(又称CG site),而哺乳类细胞中的CpG出现的频率比较低且多数被甲基化(70-80%),正因如此,细菌来源的CpG常用作疫苗治疗癌症时的佐剂。在2000年,Shizuo Akira的团队揭示了这个感知细菌DNA的受体,通过序列比对分析他们发现一个基因与之前的TLR基因比较类似,故按序命名为TLR9。他们利用BLAST、DNA探针杂交以及基因敲除的小鼠在体内和体外确认了TLR9感知细菌DNA的作用。[4](当时人们只知道TLR有8位成员)现在人们已知细菌的、病毒来源的DNA均可以被浆类树突细胞(plasmacytoid dendritic cells)、单核细胞(monocytes)、NK细胞和B细胞等内定位在内溶酶体(endolysosomalcompartment)中的TLR-9识别。

CpG on one DNA strand (left), and complementary C-Gbase-paring on two DNA strands (right).
(From Wikipedia)
发现了识别外源DNA的受体,人们瞬间感觉疑惑顿开,希望尽快揭示其中隐藏的分子机制。过了五年左右,有人发现TLR9缺失的细胞被外源DNA刺激后依然具有抗病毒免疫的能力。[5]后续有人提出一种解释:富含AT序列的DNA在细胞质中经RNA Pol III(真核细胞中的一种RNA聚合酶,用于转录核糖体5S rRNA、tRNA和一些小分子RNA)转录后产生的RNA可以激活RIG-I通路,进而活化免疫系统。然而大多数DNA分子,包括微生物来源的DNA,并不能起始RNA pol III介导的转录。这也就是意味着一定存在某种和TLR9不同的通路,能够感知细胞质中的DNA。
STING
究竟会是什么呢?如何寻找呢?确实非常的吸引人,一个应该是广泛存在的通路,还和先天免疫相关,我想没有人愿意在这里放慢脚步,这也许可以看成是科学的自我进化。没过多久,三个课题组先后报道了发现新的DNA sensor可以介导DNA引起的免疫波动:一篇的切入点时寻找诱导IFN表达的蛋白,他们选用了一个融合了IFN-β启动子的报告基因,筛选了5500个人源的和9000个鼠源的基因,后来发现了STING(stimulator of interferon genes);[6]一篇的入手处是寻找调节NFκB和IRF3活性的蛋白,在刺激IFN表达的上游通路中,也是用过表达文库的实验进行筛选,使用的报告基因是融合了IRF3响应的特异序列(ISG54启动子中的IRF-E),前后筛选了约200,000个克隆,后来发现了MITA(Mediator of IRF3 Activation);[7](稍稍看了一下作者,原来是武汉病毒所的舒红兵教授的课题组完成的工作)另一篇利用鼠骨髓来源的巨噬细胞的cDNA文库进行筛选,报告基因也是IFN-β-Luciferase,希望找到能够上调IFN-β的蛋白。后来他们发现了ERIS(endoplasmicreticulum IFN stimulator),并揭示该分子的二聚化对免疫系统活化至关重要。[8]再后来人们发现,这三个蛋白其实是同一个,最终统称为STING。
到此,人们只是打开了一扇门,看到了细胞识别细胞质中的RNA和DNA的多种方式,应该还有更多种,亟待被科学家解开他们的面纱。没用几年的时间,人们先后发现了DNA sensor-STING-TBK1-IRF3-TypeI IFNs的通路中的关键成员,DNA sensor也接连走到人们面前,比如DAI、DHX9、DDX41等等,可是这些发现还是暴风雨来临的前奏,因为缺失任何一个DNAsensor都无法向缺失STING那样阻断DNA诱导的免疫活化。这又一次表明,在这些DNA sensor之外,还存在着一种或更多的DNAsensor能够将信号传递给STING。那么,这又会是谁姗姗来迟呢?
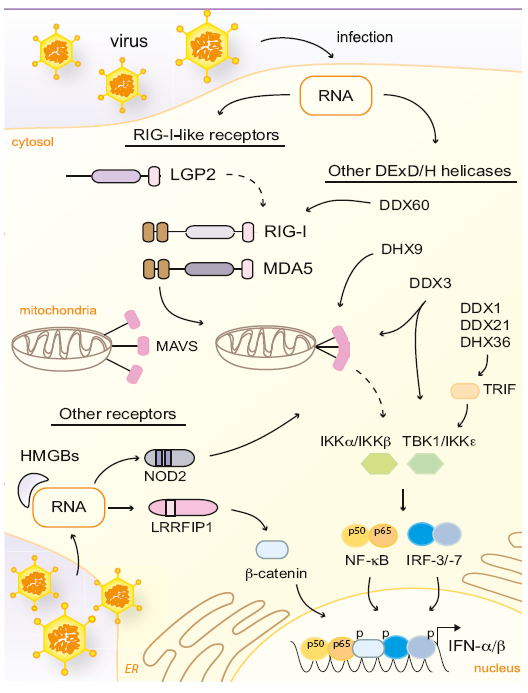

Cytosolic RNA Sensing and Intracellular DNA Sensorspost virus infection[3]
The cGAS-STING axis
2009年到2011年间,人们陆续发现细菌里的第二信使环鸟苷二磷酸(cyclindi-GMP, c-di-GMP)可激活STING依赖的免疫系统,诱导IFNs的表达。2011年8月,RussellE. Vance等人用同位素标记的方法发现在动物细胞中STING本身是可以直接感知c-di-GMP的DNA sensor,并且初步用缺失的方法发现几处重要的位点,比如STINGR231A则无法继续响应c-di-GMP的刺激。[9](我很好奇作者做了多少工作才发现这一突变?当时还没有晶体结构数据的支持,该如何设计突变呢?还是参考前人发现的关键位点小试一下而已呢?)后续的晶体解析工作显示c-di-GMP结合在STING经二聚化在C端形成的V型口袋。不过当时人们还不确定STING是否可以直接与DNA结合。
到2013年(文章接收时间是2012年圣诞节前夕),陈志坚教授的团队在Science期刊连续发表两篇重量级文章报道环鸟苷酸-腺苷酸(cyclin GMP-AMP, cGAMP)作为第二信使可直接活化STING,[10](这也是首次发现哺乳动物细胞中存在cGAMP)并且发现cGAMP上游关键合成酶——cGAS。[11]他们的思路和实验设计都比较巧妙:一方面抓住细胞质DNA激活STING通路时序列不依赖的过程,表明存在某种更普遍的分子机制;一方面他们提取了细胞的亚组分,这和当年利用排除法确认DNA是遗传物质的过程类似,首先要确认是哪种组分是激活STING的关键。首先选用一株易通过STING诱导表达IFN的细胞系(鼠纤维肉瘤细胞系L929),经shRNA干扰STING的表达,在过转DNA激活STING上游通路的某种因子,再与经perfringolysin O(PFO,被穿孔的细胞膜被破坏,但亚细胞器不会流出细胞,包括ER上的STING)穿孔的人源单核细胞系THP1或鼠源巨噬细胞Raw264.7共孵育,若转染的DNA刺激了STING上游因子的活化,所提取的细胞提取物会将信号传递到THP1或Raw264.7中的STING,进而引发IRF3的活化,也就是会产生二聚化的IRF3。

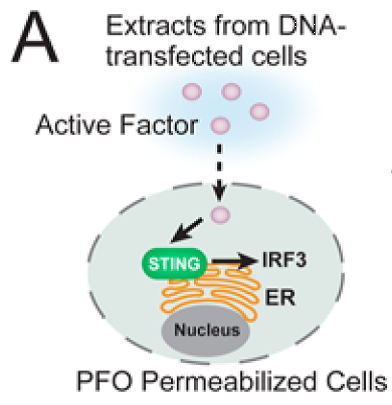
Illustration of an activity assay forcellular factors that activa4te the STING pathway[10]
实验中选用的DNA包括刺激IFN表达的DNA(interferonstimulatory DNA, ISD)、poly[dA:dT]、GC-rich的50bp长的dsDNA、poly[dI:dC]和herring testis DNA (HT-DNA),结果显示这些不同类的DNA均可诱导IRF3的活化,表明STING的活化对转染的DNA并没有选择性;接下来验证STING上游的因子是否是蛋白,作者利用95˚C热灭活的方法去除蛋白的影响,很快,人们惊奇的发现了二聚化的IRF3——表明STING上游的活化因子并非蛋白,比较而言是核酸的可能性更大,或者说可以兴奋的猜测就是DNA还是RNA!显然,要立刻验证究竟是谁,这时核酸酶(Benzonase)、蛋白酶K、DNA酶和RNA(类似)结构被派上来试探一下,Waoooh,结果清晰的显示了STING上游活化的因子竟然是DNA!
做到这里已经是上一个台阶,需要通过不同的对照组反复验证,比如其他细胞提取物如何、是否通过RNA pol III、是否依赖RIG-I、是否仅通过STING等等,结果没有再出现意外的发现。接下来作者没有停下脚步,而是继续寻找STING上游的这个“DNA”活化分子到底是什么结构,毕竟DNA的情况过于复杂:多长?多短?二级结构?有何特征?不过前不久发现的c-di-GMP到是给了他们一些提示,可是利用色谱结合LC/MS的方法并未发现所测试的细胞中存在c-di-GMP,不过获得的一些线索显示细胞提取物种含有某种c-di-GMP和c-di-AMP杂交的结构——也就是c-GMP-AMP(cGAMP)!(看到人们分析分子结构时的图谱,让我想起Met-ID的工作,就是通过LC/MS的分子量反推代谢产物可能有哪些)

Expected fragmentation patterns of cGAMP[10]
看到这里好比身临其境,这是多么让人激动的结构啊,过了午夜也无法停下来,希望看到后面的故事!
暂且不说这个小分子的结构多么简单、精美,之前并没有工作报道真核细胞中存在cGAMP的分子,这将引来多少创新的工作,定会吸引一批有干劲的年轻人,若是得以揭示cGAMP在真核细胞中也是一种第二信使,那后续的工作就更多了。闲话不多说,作者继续验证cGAMP能否直接活化STING,是否还存在其他可能的DNA分子?接下来Chemists上场了,直接合成cGAMP再刺激细胞,检测IRF3和IFN的活化水平。期间还发现HEK293T内的STING的表达量过低(两个月前的一篇文章显示原代肝细胞中STING表达量较低,可能是易被HBV感染的原因之一[12]),不适合用分析cGAMP的效果,相比而言L929、THP1和巨噬细胞等更为合适,结果清晰明显。文中涉及了三个实验:1,过表达或稳转STING;2,KnockdownSTING的表达;3,分析STING是否可以与cGAMP直接结合。结果都显示cGAMP可以作为细胞质DNA激活免疫系统过程中的内源第二信使。[10]

Cyclic dinucleotides in prokaryotes and metazoans [13]
不难猜测,作者一定在开展验证实验的同时也在寻找cGAMP上游的分子,这个难度应该小了不少,并且作者在发现cGAMP的同时在体外实验已经看到ATP和GTP的必要性。在未找到相应的合成酶之前,作者将之称为cGAS。余下的过程就是将L929细胞中的亚组分用不同的方法分别纯化,选用4步色谱技术分离,还有一组用生物素标记的寡聚DNA进行亲和层析。分析收集到的不同分离组分对STING的激活能力(直接分析IRF3的二聚化),再联合定量质谱分析,发现3个蛋白经三种路线纯化后依然存在,比对序列后发现一个与人源OAS1催化结构域同源的蛋白——他就是cGAS。后续的结果验证了cGAS定位在细胞之中、可以起始I型IFN的表达、是转染DNA或感染病毒后诱导IFNβ过程中必要的成员、体外酶学试验也直接显示cGAS可以结合DNA并且能催化ATP和GTP合成cGAMP;此外,作者还证实过表达其他DNA sensors时不会产生cGAMP,Knockdown以后也不会抑制cGAMP的产生等等。

Purification of cGAS and itsidentification by quantitative mass spectrometry[11]
到此,cGAS-cGAMP-STING通路闪耀登场,时值2013年伊始,那个时候我还在读研二。没想到几年过去了,现在才发现这条和自己毫不相干的通路。现在看起来简单虽说只是简单的几篇文章,可是他们的重要性是里程碑性的,好比同一时期的几篇文章阐述了CRISPR/Cas9的工作机制。到现在已经过去两年多,该领域的成果如雨后春笋般展露,可见她的重要性。
从STING到DNA sensors 、从OAS到cGAS、从c-di-GMP到cGAMP,这段路走的并非漫长,若是站在当时的情形之下,我想人们更关注的还是这条通路接下来能带来哪些新奇。首次发现哺乳动物细胞中的cGAS和cGAMP,这就有很多工作可以开展;首次发现STING可以直接结合cGAMP,又给人们许多遐想的空间;STING和IFN和免疫,就会想到该通路在肿瘤、病毒、免疫等疾病中的角色;当然,要是能直接了解她们的晶体结构将会直接、便捷的提供重要的信息(估计目前的结构早已被解出)。
如此新奇的发现,着实鼓舞人心!我想该是时候回头看看TLR的过去和现在了。

OAS1–RNase L and cGAS–STING axes in innate immunesignalling and antiviral defence[13]
TJ Pharmaron
Sep. 07, 2016 Wed
Reference
1. Paludan, S.R.and A.G. Bowie, Immune sensing of DNA.Immunity, 2013. 38(5): p. 870-80.
https://blog.sciencenet.cn/blog-571539-1004516.html
上一篇:A story between HBV and STING
下一篇:To Fanfan (X)