博文
神奇的负温度是怎样一种存在?
||
神奇的负温度是怎样一种存在?
物理学家告诉你,你永远达不到绝对零度。如果能,你将实现百分百的效率将热能转化为动能。如果你能建造一台能够达到绝对零度的制冷机,它将为你带来数以亿计的财富。但在这里,我还是劝你不要去尝试、不要去挑战。另一方面,物理学家又告诉你,这个世界还存在负温度,是不是又看到了建造百分百效率热机的可能。但事实上,你还是没有可能。而且物理学家还说了,负温度的物体比正温度的物体还要“热”。那么,物理学家提出的负温度到底是个什么鬼?
1. 我们先来看看什么是“温度”
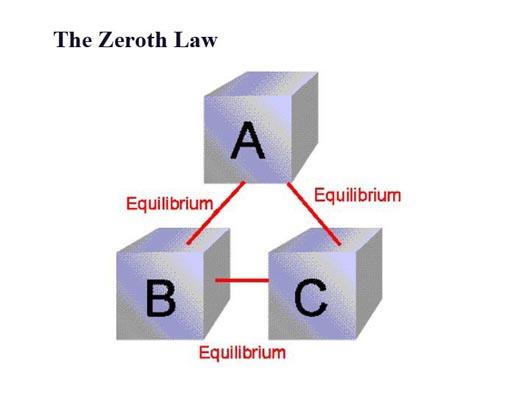
热力学除了我们常提到的第一、第二、第三定律,还有一条重要的第零定律,这一条定义了温度。(热力学四定律统计力学1-热力学回顾(四大定律简述) - 知乎专栏)
首先,我们需要明确一下的温度概念。实际上,有各种“温度”出现在物理学文献(例如动力学温度,色温)中。其中一个来自热力学,从某种意义上来讲热力学中的温度是最根本的。
我们直观的观念认为,当且仅当两个系统温度相同时,它们之间的热接触才不会交换热量。我们来看两个系统S1和S2,将S1和S2合并的系统称为S3。我们怎样对温度做定量的定义,这是关键,即“S3的能量在S1和S2之间如何分配?(我将简要解释一下,但是我建议您阅读Kittel和Kroemer(参考如下)的文章,文章对对这一重要和根本的概念做了细致,简洁和深入的解释。)
系统S3具有许多可能的状态(我们称之为微观状态),因为S3的原子可以以许多方式共享其总能量E。假设系统有N个原子,每个微观态对应于两个子系统S1和S2对总能量的一种分配。多个微观状态可以对应于同一种能量分配:S1的能量为E1,S2为E2。当系统S3的微观状态数N(E1,E2)达到最大值时,系统S3将处于一种最稳定状态。( N(E1,E2)是每个子系统允许的状态数的乘积:N(E1,E2)= N1(E1)N2(E2),E1 + E2 = E. )对于给定总能量的情况,E1和E2不再变化时,N(E1,E2)达到最大值。
为方便起见,物理学家们习惯用熵S(即S = k ln N)来描述问题。 在给定体积和粒子数的情况下,当(∂S/∂E)1 =(∂S/∂E)2时,两个系统达到热平衡。也就是说,对于两个系统(给定体积和粒子数),熵S随着能量E的增加的变化率必须相同。否则,当组合系统向最大总熵的状态变化时,一个子系统的能量将流向S3的另一个子系统,因为S3随机地从一种状态到另一种状态。我们在给定体积和粒子数的情况下,定义温度T=∂E/∂S,使得平衡条件的描述变得简单,即T1 = T2。
温度的统计力学定义,事实上符合我们对大多数系统的温度的直观概念。只要∂E/∂S为正,T总是为正。对于一般情况,能量的增加总是导致可能的微观状态数的增加,并且随着总能量的增加而越来越快地增加。因此,在一般情况下,随着系统能量的增加,系统的温度会随之增加,并且逐渐地接近正无穷大。
2. 什么是“负温度”?
熵随能量的增加而增加的性质并非适用于所有系统。在某些情况下,随着系统能量的增加,系统可能的微观状态数在减少。例如,想象一个理想的“自旋系统”,系统含有N个原子,每一个原子都具有1/2的自旋。磁场中,原子的自旋只允许两种方向:“向上”或“向下”。在场强为B指向向上的磁场中,系统的总能量为(D-U)μB,其中μ> 0是每个原子的磁矩沿B方向的分量的大小,D和U分别为分别为“自旋向下”和“自旋向上”的原子数,自旋向上时原子处于d能态,自旋向下时原子处于高能态。按照这种定义,当所有原子中有一半自旋向上,另一半自旋向下时,系统能量E为零。
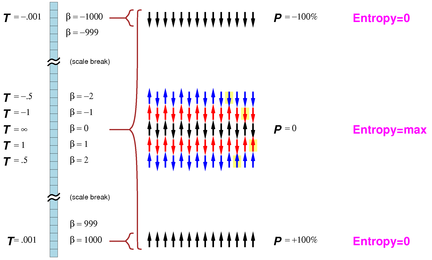
最低可能的能量状态(所有原子自旋指向上)给出系统总能量为-NμB,此时温度为零度。在此情况下,系统只有一种可能的状态:所有原子的自旋方向都指向上。熵是微观状态数对数的k倍,因此在这种情况下,系统的熵S=k ln 1 = 0。如果现在我们升高温度,向系统注入2μB的能量,相当于有一个原子的自旋向下翻转。总共有N种方式,所以新状态的熵为k ln N。如果我们向系统增加2*2μB的能量,相当于有两个原子的自旋向下翻转,那么对应总共有N(N-1)/ 2允许的可能性,这个状态的熵值为k ln N(N-1)/2。在上述的过程中,系统的能量在增加,系统的熵随之增加,系统的温度也在升高。
但是对于这个系统来说,熵不会永远增加。当所有自旋都翻转向下时,系统具有最大能量NμB。此时,系统只有一种微观状态,熵再次回归为零。如果我们从系统中拿掉2μB的能量,使得一个原子的自旋向上。系统的处在此能量时对应有N个可能的微观状态,此时系统的熵为k ln N。在这个过程中,系统的熵随着能量的降低而增加。事实上,系统的总能量为零时系统的熵达到最大值,此时有一半的原子自旋向上,另一半自旋向下。
所以对于这个自旋系统,当系统的能量增加时,系统的温度从零开始升高,并且随着最大熵的逼近而增加到一个足够大的正值,这时有一半的原子自旋从开始时的向上转为向下。之后,随着能量的增加,温度变为绝对值很大的负数,继续增加能量,温度再次回到零开。 如果有两个相同的自旋系统,一个处于正温度,另一个处于负温度,并使它们发生热接触,热量将从负温度系统流入正温度系统。此时,负温度系统比正温系统更热。
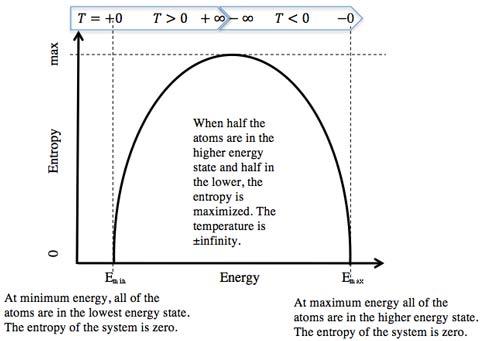
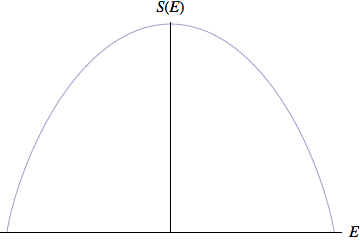
3. 与现实世界有什么关系?
负温度系统是可以在现实世界中实现,还是仅是理论凝聚态物理学家的无厘头发明?
原子总是具有除自旋以外的其它自由度,这些自由度通常使系统的总能量升高。因此,只有在一些特殊情况下可以得到负温度。当系统满下列足条件时,定义原子自旋系统的“自旋温度”是有意义的。
1.原子自旋与其它自由度之间的耦合足够弱
2.原子之间的自旋耦合足够强
3.能量从自旋流动到其他自由度的时间尺度相比能量在自旋之间转化的时间尺度足够大
有两个具体的例子。1. 在强外磁场中的核自旋情况下,这种情况可以很容易地得到满足,核和电子自旋系统可以通过合适的射频技术得到负温度。2. 激光体系中粒子数反转。
下面列出的文章及其中的参考文献可以找到关于负温度的几个实验
参考文献
Kittel和Kroemer,Thermal Physics,附录E.
N.F. Ramsey,“Thermodynamics and statistical mechanics at negative absolute temperature”,Phys。修订版103,20(1956)。
M.K.Klein,“Negative Absolute Temperature”,Phys。 Rev. 104,589(1956)。
https://blog.sciencenet.cn/blog-566204-1157962.html
上一篇:Ising 模型
下一篇:薛定谔的猫