博文
回顾 | 2018年表观遗传学亮点研究(上)
|
本周小编将根据自己的理解,总结小编心目中2018年度“表观遗传学”亮点研究。因为篇幅较长,将分上下两篇,请您雅鉴。
表观遗传学最早在1939年由英国发育生物学家C. H. Waddington首先提出。目前表观遗传调控机制主要通过DNA甲基化(DNA methylation)、组蛋白修饰(Histone modification)、染色质重塑(Chromatin remodeling)和非编码RNA调控(Non-coding RNA)等方式来实现。
组蛋白修饰是表观遗传学研究的核心热点,2018年9月,Albert Lasker基础医学研究奖便授予了在组蛋白功能和修饰研究中做出开创性贡献的两位科学家:Michael Grunstein和Charles David Allis。近些年来,随着蛋白质组学技术以及抗体技术不断发展,越来越多的新型组蛋白修饰以及新颖的调控机制被揭示出来,并见诸高水平期刊。
Cell:肿瘤表观遗传靶点EZH2调控新模式及个性化治疗新策略
Cell:单细胞水平揭示衰老过程中组蛋白修饰变化
PNAS:pH调控GAS41作为组蛋白修饰阅读器对不同酰化类型的识别
J CLIN INVEST: 代谢酶ACSS2通过组蛋白巴豆酰化修饰调控HIV休眠,有望成为治疗靶点
Nat Commun:肠道微生物代谢脂肪酸调控宿主组蛋白巴豆酰化修饰
1. Cell:肿瘤表观遗传靶点EZH2调控新模式及个性化治疗新策略
Xun Huang, et al., 2018, Targeting Epigenetic Crosstalk as a Therapeutic Strategy for EZH2-Aberrant Solid Tumors. Cell.
2018年9月,中国科学院上海药物研究所耿美玉课题组、丁健课题组和谭敏佳课题组在国际专业学术期刊Cell上报道了针对肿瘤表观遗传异常的精准治疗策略研究成果。
该研究针对目前肿瘤表观遗传抗肿瘤药物的临床用药困境,揭示了决定组蛋白甲基转移酶EZH2抑制剂实体瘤疗效响应的核心机制,提出新的肿瘤分群策略和联合用药方案,为EZH2高表达肿瘤的个性化治疗指明方向。
研究对近百株肿瘤细胞EZH2抑制剂的敏感性和表观遗传动态修饰变化进行了系统筛查,结合基于蛋白组学的组蛋白修饰全景检测分析发现,抑制EZH2会影响数十种组蛋白修饰状态改变,导致肿瘤细胞蛋白修饰谱的重塑。其中,组蛋白H3K27位上甲基化(H3K27me)与乙酰化(H3K27ac)之间的相互转化,启动的不同肿瘤细胞中癌基因信号通路的差异活化,是导致EZH2抑制剂耐药的重要原因。
推荐理由:该研究结合组蛋白修饰谱-转录谱-蛋白质谱-磷酸化谱协同差异化分析揭示了EZH2生物学功能的发挥和H3K27甲基化与乙酰化互为依存、相互牵制的调控模式密切相关,H3K27甲基化与乙酰化的同时抑制导致激酶MAPK信号通路异常激活。为EZH2抑制剂、p300和BRD4抑制剂联合应用提供了合理依据。
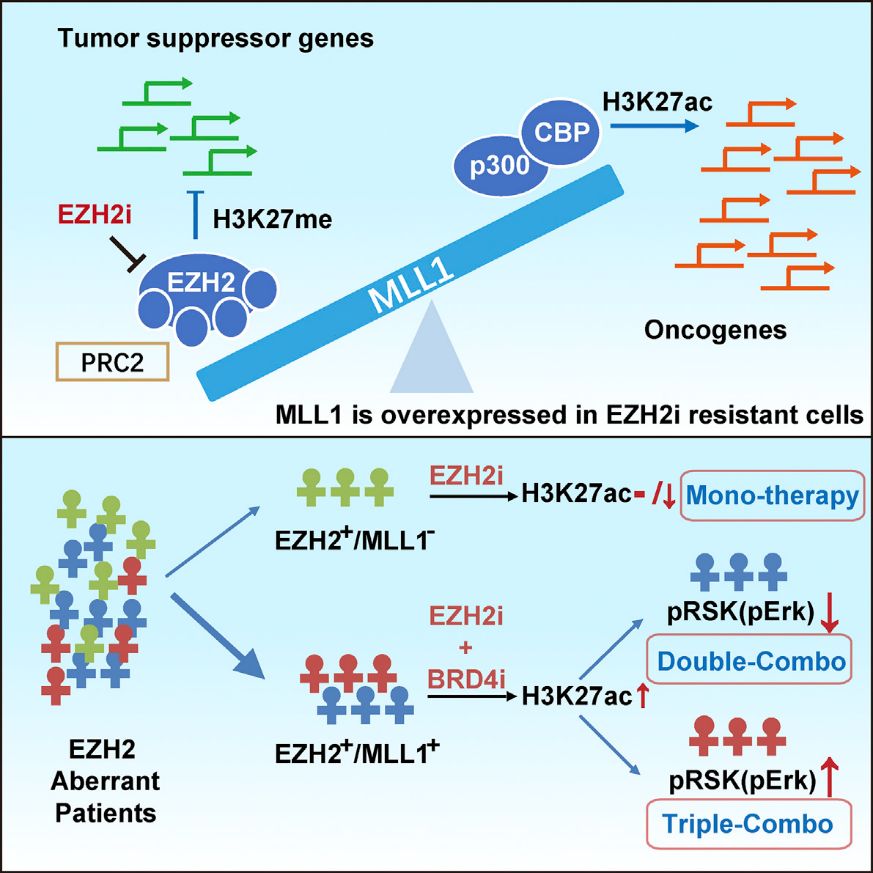
肿瘤表观遗传靶点EZH2调控新模式
2. Cell:单细胞水平揭示衰老过程中组蛋白修饰变化
Peggie Cheung, et al., 2018, Single-Cell Chromatin Modification Profiling Reveals Increased Epigenetic Variations with Aging. Cell.
2018年5月,美国Stanford大学研究者在国际专业学术期刊Cell上发表论文,研究者利用cytometry质谱实现单细胞的水平对蛋白的检测,对来源于人体的22种主要免疫细胞进行染色质修饰筛选。结果发现,不同类型的免疫细胞具有不同类型的组蛋白位点特异性修饰,且随着衰老过程的进行,免疫细胞的组蛋白修饰差异逐渐增大,表明环境因素和非遗传因素对组蛋白修饰表观调控机制的影响。
研究者应用质谱流式细胞仪进行细胞分选、质谱分离检测以及抗体检测,实现了对不同人群来源的免疫细胞多种组蛋白修饰类型(乙酰化、磷酸化、泛素化、巴豆酰化)进行定量检测筛选,构建免疫细胞组蛋白修饰谱图。研究发现利用组蛋白修饰能够很好的实现免疫细胞类型区分,且伴随个体的衰老以及环境因素的影响,免疫细胞组蛋白修饰水平差异逐渐增大,其中发挥主导作用的是非遗传因素。
推荐理由:本文利用基于流式细胞仪-质谱的方法,使得单细胞水平多通道分析蛋白质修饰成为可能,证明了组蛋白修饰谱可以用于预测细胞身份,支持了学界长久以来的认识。同时一些新型组蛋白修饰,如组蛋白巴豆酰化修饰在免疫反应细胞分化中的差异被揭示,表明了组蛋白巴豆酰化修饰在这类过程中具有潜在的关键作用。
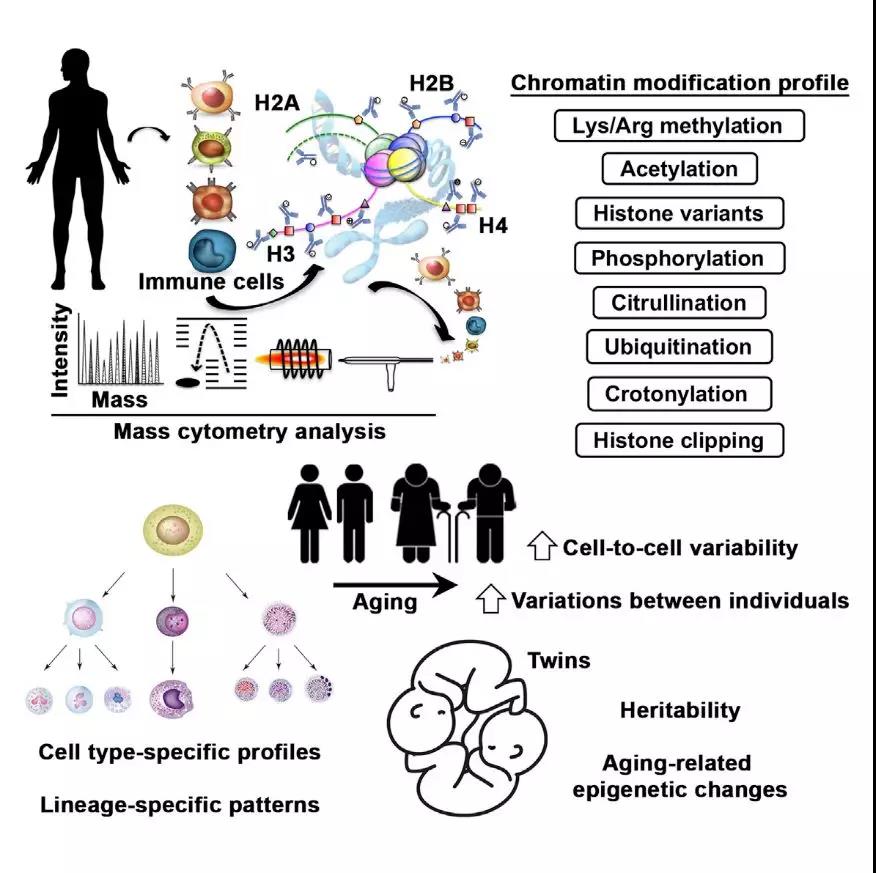
单细胞水平揭示衰老过程中组蛋白修饰变化
3.PNAS:pH调控GAS41作为组蛋白修饰阅读器对不同酰化类型的识别
Yi Wang, et al., 2018, Identification of the YEATS domain of GAS41 as a pH-dependent reader of histone succinylation. PNAS.
2018年1月,香港大学郝权课题组在著名学术期刊PNAS上报道了一种组蛋白Ksucc阅读蛋白GAS41。GAS41蛋白YEATS domain能够显著结合H3K122succ。同时还发现GAS41在不同pH条件下,其识别不同的组蛋白酰化修饰类型:在H3K122suc与H3K122cr阅读器的角色中切换。该项工作填补了组蛋白Ksucc阅读器蛋白研究方面的空白,发现蛋白阅读器调控酰化修饰的新机理,也揭示GAS41潜在的表观调控功能。
研究者对YEATS domain进行结构解析,比较具有YEATS domain的多个蛋白结构差异,发现了几个关键氨基酸残基可能是结合酰化修饰的重要位点。其中修饰识别蛋白GAS41在YEATS domain上具备带正电的43位组氨酸,研究者随即利用修饰肽段进行测活实验,成功证明了GAS蛋白能够识别H3K122琥珀酰化修饰,且在细胞内环境pH变化时,GAS蛋白对该位点的识别会变成H3K122巴豆酰化修饰。
推荐理由:组蛋白修饰识别蛋白是组蛋白修饰发挥功能的关键因子,新型酰化修饰种类多,调控复杂,其对基因表达和染色质状态的调控机制是学界关注的重点和热点,本文对GAS41组蛋白酰化修饰识别蛋白的研究揭示了新型酰化修饰识别蛋白受pH调控影响而产生的动态识别机制,为进一步深入研究组蛋白酰化修饰功能提供新的视角。
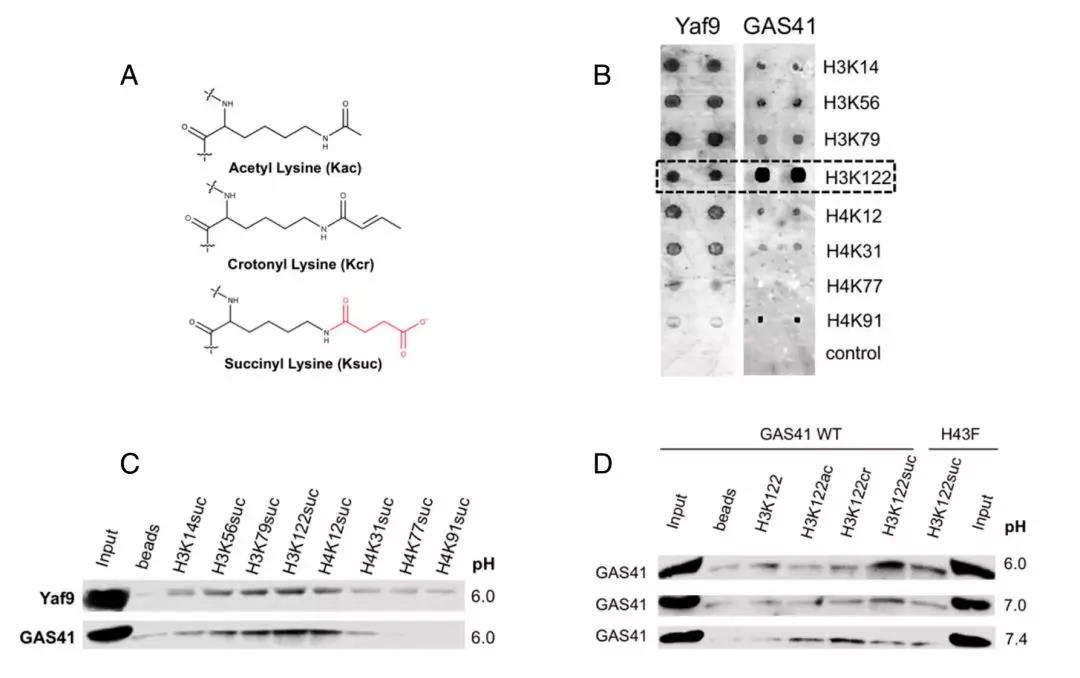
GAS41作为组蛋白修饰阅读器识别不同酰化类型
4.J CLIN INVEST: 代谢酶ACSS2通过组蛋白巴豆酰化修饰调控HIV休眠,有望成为治疗靶点
Guochun Jiang, et al., 2018, HIV latency is reversed by ACSS2-driven histone crotonylation. The Journal of Clinical Investigation.
2018年3月,来自加州大学戴维斯分校等研究机构的研究院在国际专业学术期刊The Journal of Clinical Investigation上报道了增加宿主细胞组蛋白巴豆酰化修饰水平与HIV病毒显现机制之间的关联。
早期的研究发现对组蛋白去乙酰化酶或甲基转移酶的抑制可以激活HIV并促进病毒对抗HIV药物敏感,但是效力相对较低,存在其他潜在未知的表观遗传修饰存在进而影响HIV的激活。
研究者采用巴豆酸钠处理培养的CD4T细胞,发现组蛋白巴豆酰化修饰水平的提高与ACSS2蛋白相关,对ACSS2蛋白的干扰抑制能够有效影响HIV潜伏期;通过巴豆酸钠和已报到的HIV激活药物联合用药,能够大大增加HIV病毒从潜伏期向激活状态转变。研究者通过生化实验最终梳理出ACSS2通过组蛋白巴豆酰化修饰调控HIV的休眠与激活机制。
推荐理由:组蛋白巴豆酰化修饰基团与组蛋白乙酰化修饰在结构上具有一定的相似性,本文在组蛋白乙酰化修饰的基础上,从表观遗传学角度,进一步发现新型修饰——组蛋白巴豆酰化修饰在HIV休眠与激活的表观遗传调控中扮演的重要角色,同时提出了增加巴豆酰化修饰和传统激活药物的联合用药能够大大提高HIV激活效率,为HIV的研究与治疗指明了方向。
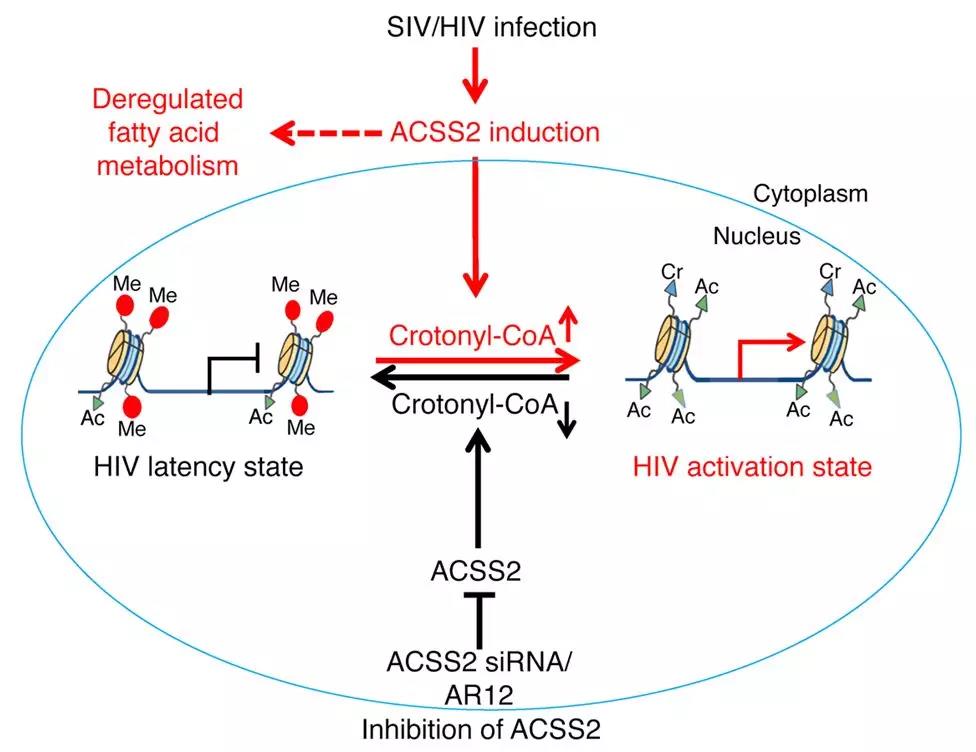
代谢酶ACSS2通过组蛋白巴豆酰化修饰调控HIV休眠
5.Nat Commun:肠道微生物代谢脂肪酸调控宿主组蛋白巴豆酰化修饰
Fellows, R.,et al., 2018, Microbiota derived short chain fatty acids promote histone crotonylation in the colon through histone deacetylases. Nature Communications.
2018年1月,来自英国Babraham研究所的科学家发现,肠道微生物可以代谢脂肪酸为短链脂肪酸SCFA,通过抑制肠道表皮细胞中组蛋白去乙酰化酶而促进组蛋白H3K18巴豆酰化修饰,调控相关基因的表达,这一成果发表在著名学术期刊Nature Communications上。
研究者通过WB实验发现小鼠结肠组织组蛋白巴豆酰化修饰水平较高,并通过质谱检测发现组蛋白上除了甲基化乙酰化等常见修饰以外,还在H3上发现多个巴豆酰化修饰位点,且H3K18巴豆酰化修饰丰度在结肠和小肠隐窝区组织最高。
ChIP-seq实验证明了H3K18cr参与基因表达过程且能够激活多种肿瘤相关基因表达。抗生素处理后的小鼠结肠部分SCFAs降低,且组蛋白巴豆酰化修饰水平降低,证明了除去肠道微生物能够通过减少SCFAs降低肠道组蛋白的巴豆酰化水平。
推荐理由:之前的研究认为SCFA只是作为碳源和能量分子,本文则表明这些化合物还可以参与调控组蛋白修饰,参与基因的表达调控。研究发现肠道微生物可以将脂肪酸分解为短链脂肪酸SCFA抑制宿主肠道组织组蛋白去酰化修饰,揭示了肠道微生物通过表观遗传调控机制对宿主相关组织基因表达调控水平。证明了环境因素包括体内微环境对个体基因表达的影响是通过表观遗传调控模式实现的。

短链脂肪酸通过抑制HDACs活性调控蛋白质巴豆酰化

景杰生物官网:www.ptm-biolab.com
业务咨询电话:400-160-1145
https://blog.sciencenet.cn/blog-3404471-1152835.html
上一篇:回顾 | 2018年蛋白质修饰组学亮点研究(下)
下一篇:禁欲时间长短为何导致受孕效果不同?蛋白组学与修饰组学分析揭示全新机制