博文
[转载]炎症小体:连接天然免疫和获得性免疫
||| |
15年前,炎症小体(Inflammasome)的发现成为科学界了解炎症发生的突破性研究1。炎症小体被证明在不同的生理环境中起关键作用,因此成为药物研发的重要靶点。本篇综述集中讨论炎症小体在天然免疫和适应性免疫之间的中心作用。
炎症小体是由细胞质传感器,细胞凋亡相关斑点样蛋白(ASC;或PYCARD)和pro-caspase-1组成的三体复合物。传感器的多样性和特异性赋予其对外源(微生物)或内源(压力信号,警报素)等各种刺激的响应。传感器包括NLRP1,NLRP3和NLRC4(属于NOD样受体家族),AIM2(absent in melanoma-2)或Pyrin。多样性和特异性的传感器可以广泛识别外源性(微生物分子)和内源性(危险信号)刺激物。
研究最为透彻的炎症小体代表是NLRP3炎症小体。其活化分两步:第一个信号(Priming)触发NF-κB依赖的pro-IL1β和NLRP3表达,第二个信号由不同结构的微生物分子(例如“毒素”)或危险信号(尿酸单钠,MSU)触发炎症小体多聚体形成。NLRP3诱导ASC活化并形成斑点,进而促使caspase-1自我切割并活化。活化的caspase-1促使IL-1β和IL-18水解成熟;并且促使Gasdermin D(GSDMD)切割。切割的GSDMD随后在细胞膜上形成孔,引发促炎性细胞死亡,即细胞焦亡(Pyroptosis)。这个过程伴随着IL-1β,IL-18和警报素如HMGB1的释放,将危险信号从受损或死亡的细胞传播出去并调动免疫细胞,特别是体现在中性粒细胞的招募2,3。此外,寡聚炎性体颗粒可通过吞噬作用(phagocytosis)被周围巨噬细胞吞噬进而放大炎症反应4。
有趣的是,在吞噬细胞处于“超活化(Hyperactivation)“状态时,IL-1β的分泌可独立于细胞焦亡的发生5,6。事实上,炎症小体诱导树突细胞(DCs)超活化,后者触发增强T细胞(enhanced T cell)应答:除保留其功能和抗原递呈外,增强T细胞促使微环境中的辅助T细胞(T helper)做出反应并分泌IL-1β和IL-18。这些细胞因子优先驱动Th1、Th17应答。IL-18可通过活化的Th1细胞诱导IFN-γ产生,IL-1β可稳定Th17细胞的分化,进而产生IL-17。此外,IL-1β也可提高初始T细胞和记忆T细胞的存活7,8。
炎症小体依赖性IL-1β分泌,可驱动Th17应答,对于防御真菌感染起到重要作用。通过C-型凝集素受体如Dectin-1识别Candida albicans等真菌抗原的特定结构(β-glucans)可导致Syk依赖性NF-κB的激活,NLRP3炎症小体组装和IL-1β驱动的Th17细胞应答9,10。值得注意的是,Dectin-1信号通路还可通过非经典的caspase-8炎症小体触发产生IL-1β9。
IL-1β和IL-18在获得性免疫中的不同功能,使炎症小体在疫苗佐剂的应用研究中备受关注。活化炎症小体的配体可调控Th1型体液免疫应答,Th1、Th17、细胞毒性T细胞免疫和免疫记忆11。例如,由于I型干扰素(IFNs)可以抑制pro-IL-1合成,但促进IL-18成熟,所以将IFN与炎症小体活化的DC混合,有希望保护Th1型应答11。最近研究发现,诱导I型干扰素的产生和NLRP3炎症小体的活化可增强Th1型应答13。
随着对炎症小体生物学机理的全面解析不断深入,如何平衡选择在有害和有益的炎症小体激活之间切换,是未来优化治疗方案不得不考虑的课题。
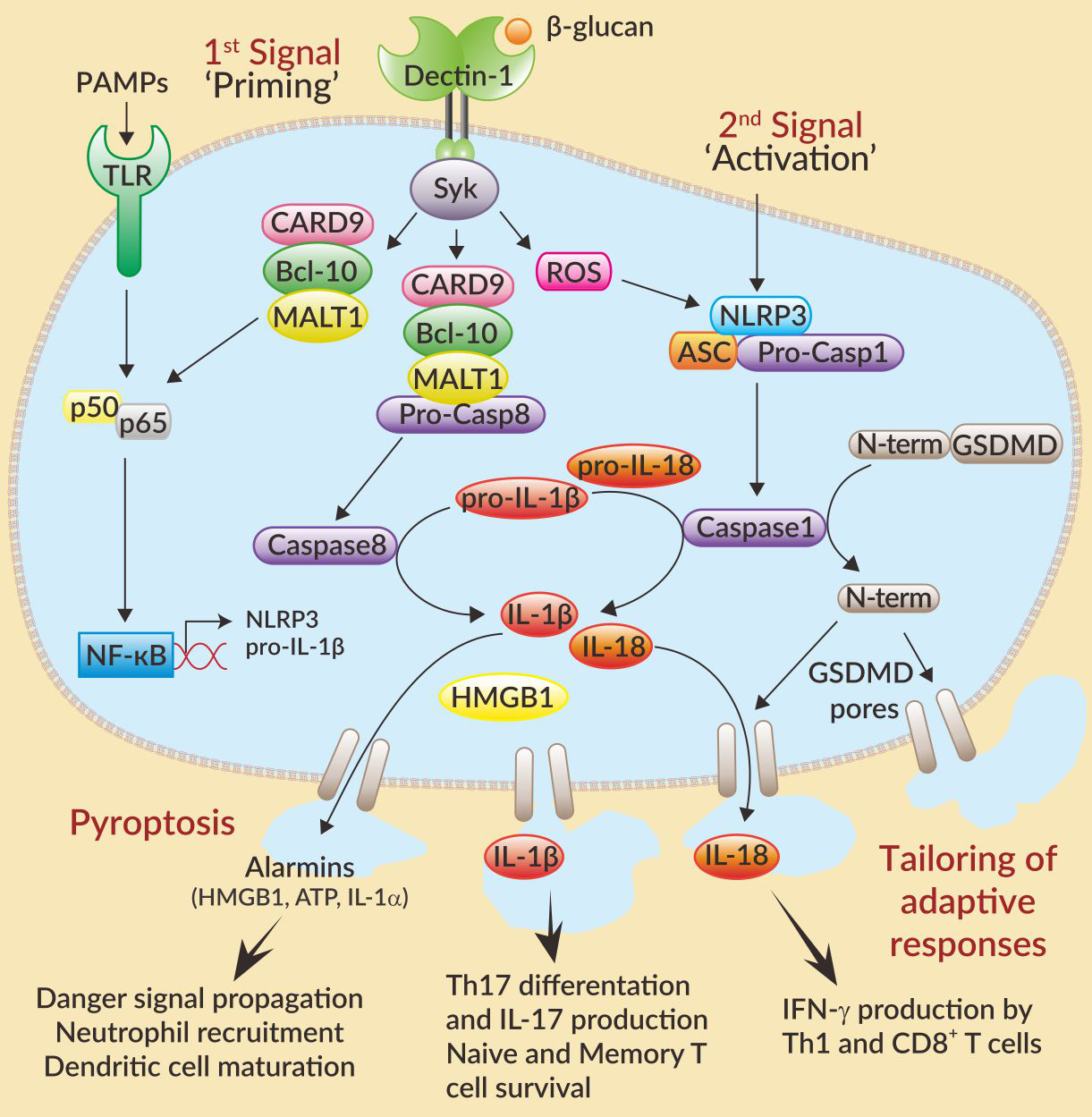
图1 炎症小体报告基因细胞
InvivoGen开发了两种THP-1衍生的报告细胞来辅助炎症小体研究。THP-1是一种单核细胞系,也是炎症小体体外(in vitro)活化研究中最常用的人源体系模型。在用炎症小体诱导剂刺激之前,需进行启动(priming)步骤以获得IL-1β的最佳释放效果。我们的THP-1衍生炎症小体报告基因细胞可用于研究两种炎症小体介导的应答,细胞焦亡(caspase-1依赖性细胞死亡)和ASC斑点形成。
THP1-HMGB1-Lucia™ Cells NEW
THP1-HMGB1-Lucia Cells 是研究细胞焦亡特点独特的工具,可对细胞焦亡进行稳定而便捷的量化检测。 该测定依赖于细胞溶解介导而释放HMGB1的测量,后者是与Lucia萤光素酶融合的警报素蛋白。
• 快速: 将细胞上清液与检测试剂混合,即可测量荧光信号
• 灵敏: 本底低,LDH 测量范围优化
• 便捷: 只需要10 μl 细胞培养上清液——适合监测动态变化
• 灵活: 可以评估细胞焦亡和IL-1β释放
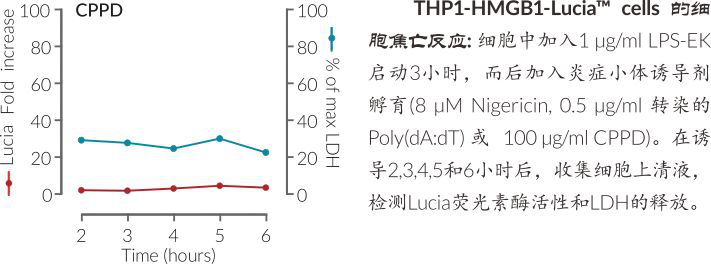
THP1-HMGB1-Lucia Cells需要在用炎症小体诱导物如Nigericin和CPPD晶体(NLRP3诱导物)或poly(dA:dT)(AIM2诱导物)处理之前用LPS预处理。炎症小体活化导致细胞焦亡介导质膜破裂,从而释放HMGB1 :: Lucia进入细胞培养液。加入检测腔肠素底物的QUANTI-LucTM,可测量光信号强弱,从而监测上清液中HMGB1 :: Lucia的水平。
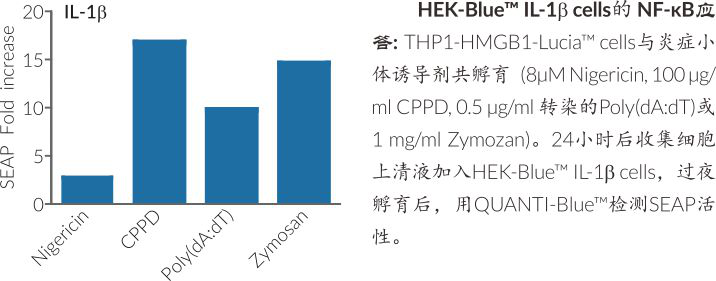
HMGB1::Lucia cell 的上清培养液也可通过IL-1β报告基因细胞,HEK-BlueTM IL-1β检测IL-1β的活性。此细胞携带NFkκB诱导性分泌型胚胎碱性磷酸酶(SEAP)报告基因,可通过加入检测试剂QUANTI-BlueTM获得相关数据。
炎症小体或以不同方式触发细胞焦亡和IL-1β分泌:Nigericin是细胞焦亡快速,强效诱导剂,却诱导产生少量IL-1β;而CPPD晶体不能触发细胞焦亡,却可以诱导产生高水平IL-1β。Poly(dA:dT)可同时强效诱导细胞焦亡和IL-1β分泌。
THP1-ASC-GFP Cells
THP1 ASC-GFP cells 稳定表达ASC::GFP融合蛋白,后者可用于实时监控ASC大蛋白复合物(specks)的形成。ASC::GFP的表达由NFkκB诱导性启动子驱动,同时还需要LPS辅助启动(priming)。因此,Poly(dA:dT)等配体活化炎症小体可通过分析ASC specks的可视荧光信号来判断。

Visualization of ASC speck formation by fluorescence microscopy: THP1-ASC-GFP cells were primed with 1 μg/ml LPS-EK for 3 hours, inducing the expression of the ASC::GFP fusion protein in the cytoplasm (left panel). Cells were then incubated with 250 ng/ml complexed Poly(dA:dT) and ASC speck formation was monitored over 1 to 3 hours post-activation. In most cells, only one speck forms upon inflammasome activation (arrows in right pannel). Scale bar: 50 μm.



炎症小体抑制剂
InvivoGen提供多种阻断炎症小体免疫应答的抑制剂。这些抑制剂可作用于不同的靶点,如:NLRP3,AIM2或caspase-1。这些抑制剂通过THP1-HMGB1-Lucia cells验证抑制炎症小体的功效,也经过HEK-Blue IL-1βcells验证是否抑制IL-1β的活化。此外,我们通过检测确保InvivoGen提供的炎症小体抑制剂无细菌污染,阻止任何实验偏差的发生。
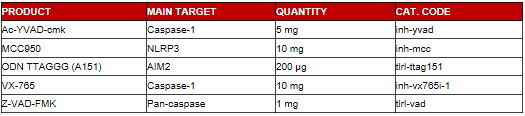

炎症小体抑制剂对THP1-HMGB1-Lucia™ cells释放IL-1β的抑制功效: THP1-HMGB1-Lucia™ cells由LPS启动,随后加入MSU (200 μμg/ml) 或转染的Poly(dA:dT) (0.5 ml) 以及0.5 μμM的各种抑制剂。孵育过夜,取细胞上清加入HEK-Blue™ IL-1β cells,孵育16小时。以QUANTI-Blue™检测SEAP活性来判断IL-1β 分泌水平。
Dectin-1a 和 Dectin-1b 报告基因细胞
InvivoGen最新推出一系列衍生自人类胚胎肾HEK293细胞系的Dectin-1报告细胞。 Dectin-1是一种C型凝集素受体(CLR),可识别真菌细胞壁中成份葡萄糖聚合物β-葡聚糖(β-glucans),因此在抗真菌天然免疫中发挥重要作用。
HEK-Blue™ hDectin-1a Cells NEW
HEK-Blue™ hDectin-1b Cells
HEK-Blue™ mDectin-1b Cells NEW
Dectin-1可被剪接成2种主要的同种型:全长A型和“无茎型(stalkless)”B型,二者不会对可溶性和颗粒状β-glucans产生相同的反应1。小鼠RAW 264.7巨噬细胞内源性同时表达两种Dectin-1剪切型,但表达水平较低,而HEK293细胞不表达Dectin-1。因此,我们构建了稳定过表达人源dectin-1a或-1b亚型和NF-κB诱导型分泌碱性磷酸酶(SEAP)的HEK-Blue细胞。这些细胞还完整构建Dectin-1信号通路所需诱导活化NF-κB的基因。
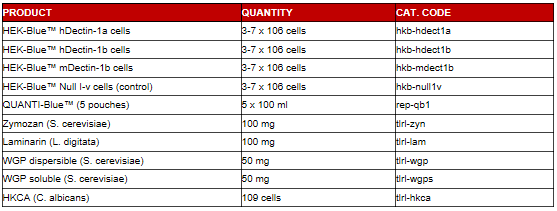

HEK-BlueTM hDectin-1a、-1b和HEK-BlueTM Null I-v cells中,Dectin-1激动剂诱导NF-κB活化:10 μg/ml Zymozan, Laminarin, WGP soluble,100μg/ml WGP dispersible, 或 3 x106 cells/ml HKCA.10 ng/ml TNF-α为阳性对照。24小时后,以QUANTI-Blue™检测SEAP活性来判断NF-kκB活性。
尽管HEK-BlueTM hDectin-1a细胞对颗粒和可溶性配体均有良好的响应,但HEK-BlueTM hDectin-1b细胞对颗粒配体的应答降低,对可溶性配体的应答极弱。这与长期有争议的可溶性配体如昆布多糖(laminarin)对Dectin-1的拮抗剂活性是一致的。此外,这些结果进一步支持最近的报告,可溶性配体的大小和纯度决定了它们的激动剂/拮抗剂活性2。我们的细胞系能够特异性测定可溶性和微粒化合物的生物活性。
参考文献
1. Heinsbroek, S.E, et al, 2006. Expression of functionally different Dectin-1 isoforms by murine macrophages. J Immunol. 176: 5513.
2. Smith A.J., et al, 2018. Immunoregulatory activity of the natural product Laminarin varies widely as a result of its physicial properties. J Immunol. 200:788.
https://blog.sciencenet.cn/blog-279293-1215145.html
上一篇:[转载]佟彤:不上火的生活
下一篇:《传染病辨证体系规范化实践》即将出版