博文
EFL课题组生物3D打印研究阶段性工作总结
|||
EFL课题组生物3D打印研究阶段性工作总结
生物3D打印(3DBioprinting)又称“生物增材制造”,从广义上来分,生物3D打印大致可划分为四个层次:第一层次为制造无生物相容性要求的结构,比如目前有广泛应用的手术路径规划用产品的3D打印、手术导板等;第二层次为制造有生物相容性要求,不可降解的制品,比如钛合金关节、缺损修复的硅胶假体等;第三层次为制造有生物相容性要求,可降解的制品,比如活性陶瓷骨、可降解的血管支架等;第四层次就是狭义生物3D打印,即操纵活细胞构建仿生三维组织,比如打印药物筛选及机理研究用的细胞模型、肝单元、皮肤、血管等。
开发合适的生物墨水一直是生物3D打印中的一个核心问题,浙江大学贺永教授课题组多年从事生物3D打印研究,已成功实现GelMA基“生物墨水”的产业化,解决了生物墨水的批次差异性大、批量化稳定性差等问题,被国内外百余个课题组所应用。生物墨水作为典型的软物质材料,可打印性一直是研究的焦点所在,该课题组对可打印性进行了系统的研究,从墨水的调控、打印中的误差控制、研究精准成形工艺等角度对生物墨水的可打印性展开了系列研究,实现了水凝胶精确打印及单细胞分辨率的操控(图1)[1,2]。

图1 GelMA水凝胶复杂结构打印

GelMA基生物墨水
活性组织内遍布的各类血管是器官保持活性的根本,只有有效的加工出相似的血管网络才有可能实现营养的有效输送,确保3D打印后形成一个真正的活性器官。常见的方法是先制造类似血管的流道结构,然后包覆在凝胶结构中,或者是基于牺牲工艺的流道构建技术。但是这些方法需要的工艺过程复杂,无法实现支架结构和流道网络的同时打印,难以在内部构造有效的流道。贺永课题组提出了一种全新的基于中空凝胶纤维融合工艺的细胞打印方法,实现了支架结构和流道网络的同时成形(图2)。通过课题组自行研发的三维打印机,利用同轴喷头制造出中空凝胶纤维,通过三维打印平台控制中空凝胶纤维的沉积位置以及控制凝胶反应的交联时序,使中空凝胶纤维融合一起形成具有内置流道的三维结构。课题组通过大量的工艺实验,系统解决了凝胶融合工艺;证实了融合后的凝胶结构强度适合于器官打印要求;并通过后续的细胞培养验证了营养通道的有效性[3]。在本方法的基础上,课题组提出了一种血管3D打印工艺,该工艺能实现宏微跨尺度血管结构的打印,宏观流道可用于各种机械力的加载,微观通道可用于营养输送以及化学物质的加载。课题组通过大量的工艺实验,系统解决了跨尺度血管结构的成型问题,成功构建出了含成纤维、平滑肌及内皮细胞的三层血管结构[4],进一步的课题组建立了体外血管模型,CD31、Vinculin及Ve-Cadherin抗体染色表明,已成功构建出了接近体内血管功能的血管芯片。随后通过炎症诱导因子的加载,模拟了动脉粥样硬化等病理条件下血管的炎症反应[5]。在相关工作的推动下,同轴生物3D打印方法已经发展成为一个新兴的研究方向。
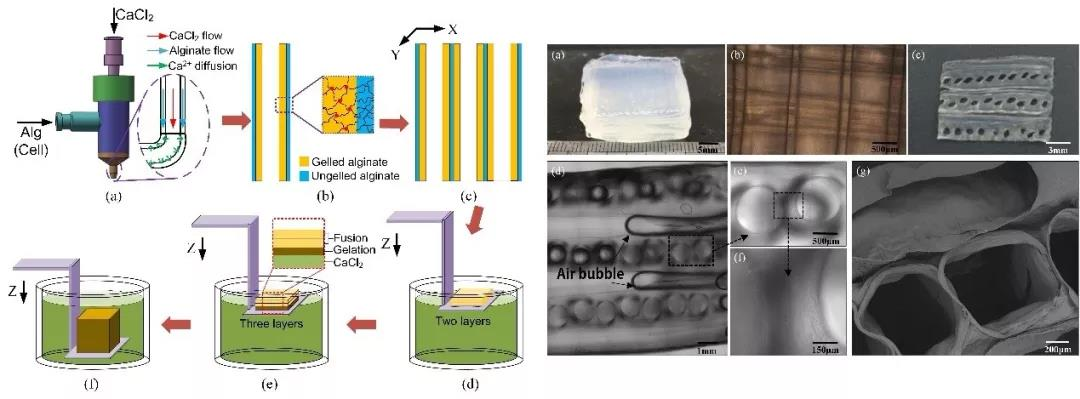
图2 同轴生物3D打印方法
类器官是药物评价、器官病变机制等研究的有效工具,课题组发明了一种气流辅助异质螺旋微球类器官的成型工艺(图3),首次实现了在微球内构造出复杂的活性结构[6]。该方法精度可达到单细胞分辨率,为类器官的高效及精准构建提供新思路,相关工作刊登在Small杂志上并被选为封底论文。课题组受到旋绳效应的启发,实现了GelMA材料异质微纤维的制造,可打印多种组分,多种形态的纤维状迷你组织。在微纤维中包裹了内皮细胞,内皮细胞在很短的时间内即可迁移到纤维表面,形成螺旋等各种微血管结构[7]。此外,课题组提出了电场辅助的GelMA微球制造方法,解决了低浓度GelMA成形的难题。通过细胞包裹、药物控释、生物3D打印三个典型案例展示了GelMA微球在组织工程领域的潜在应用[8]。
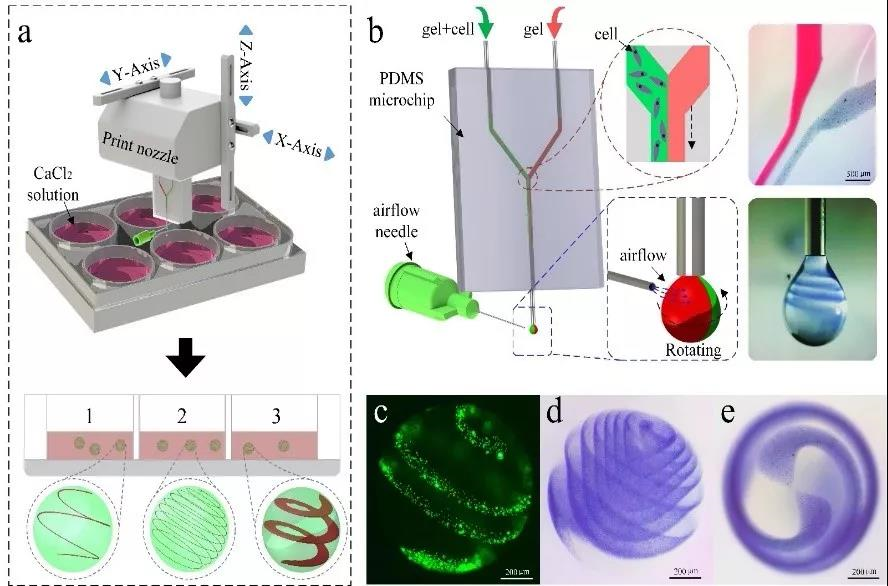
图3 气流辅助异质微球类器官的成型工艺
生物3D打印的组织结构除了在器官发育机制、病变机理、药物评价领域有众多应用外,课题组一直在思考如何将载细胞打印变成成标准的临床产品。从临床产品视角出发,我们认为打印的结构需要满足:1)包裹细胞的水凝胶材料生物性能优异,便于让包裹的细胞发育出功能;2)打印工艺简单稳定,可量化稳定制造;3)打印后的结构可长期储存,能像创可贴一样随取随用。由于水凝胶纤维结构简单,易于营养渗透及包裹细胞的功能化,我们认为水凝胶纤维是非常有潜力成为临床产品的结构。围绕这三个需求,课题组选用高生物活性的GelMA水凝胶作为细胞包裹材料,在纤维上成功实现了血管类器官、毛细管新生(血管出芽)、血管化肿瘤等结构的构造,证明了GelMA载细胞结构可以高效的实现细胞的功能化;开发了同轴打印工艺,可稳定、大批量地制造GelMA纤维,实现载细胞纤维的量化生产;制备的载细胞纤维还可通过冻存长期稳定的保存,取出后又可快速恢复功能,这样可建立一个载细胞微纤维银行,实现随取随用。相关工作刊登在Advanced Heathcare Materials杂志上并被选为封底论文[9]。

图4 产品化载细胞GelMA纤维的要求
基于以上研究,课题组已发表相关论文20余篇(3篇封面),撰写著作1部[10],如图5所示。此外,为了降低医学人员使用生物3D打印机的门槛,课题组还联合苏州智能制造研究院产业化了EFL-BP系列模块化生物3D打印机(图6),其最大特点是可直接置入超净工作台,功能通过模块可灵活配置,操作简单易用。可搭载气动、挤出、高精度直写(3到5微米打印精度)、光固化等喷头,支持细胞、水凝胶、生物陶瓷、PLA、PVA、PBS等材料。

图5 课题组撰写的专著及发表的论文封面

图6 苏州智能制造研究院推出的EFL-BP系列生物3D打印机
(a)BP66系列挤出式打印机;(b)BP58系列高精度(2微米精度)打印机;(c)BP86系列(全球首款商业化投影式光固化生物3D打印机)
[1] He Y, Yang F F, Zhao H M, et al. Research on theprintability of hydrogels in 3D bioprinting[J]. Scientific reports, 2016, 6:29977.
[2] Gao Q, Niu X, Shao L, et al. 3D printing of complexGelMA-based scaffolds with nanoclay[J]. Biofabrication, 2019,11: 035006.
[3] Gao Q, He Y, Fu J, et al. Coaxial nozzle-assisted 3Dbioprinting with built-in microchannels for nutrients delivery[J].Biomaterials, 2015, 61: 203-215.
[4] Gao Q, Liu Z, Lin Z, et al. 3D bioprinting of vessel-likestructures with multilevel fluidic channels[J]. ACS biomaterials science &engineering, 2017, 3(3): 399-408.
[5] Nie J, Gao Q, Wang Y, et al. Vessel‐on‐a‐chip with Hydrogel‐based Microfluidics[J].Small, 2018, 14(45): 1802368.
[6] Zhao H, Chen Y, Shao L, et al. Airflow‐Assisted 3D Bioprinting ofHuman Heterogeneous Microspheroidal Organoids with Microfluidic Nozzle[J].Small, 2018, 14(39): 1802630.
[7] Shao L, Gao Q, Zhao H, et al. Fiber‐based mini tissue withmorphology‐controllableGelMA microfibers[J]. Small, 2018, 14(44): 1802187.
[8] Xie M, Gao Q, Zhao H, et al. Electro-Assisted Bioprintingof Low-Concentration GelMA Microdroplets[J]. Small, 2018: 1804216.
[9]Shao L, Gao Q, Xie C, etal. Bioprinting of Cell-Laden Microfiber: Can It Become a Standard Product?[J].Advanced Healthcare Materials, 2019: 1900014
[10] 贺永,傅建中,高庆著. 生物3D打印:从医疗辅助制造到细胞打印,华中科技大学出版社,2019
https://blog.sciencenet.cn/blog-2159320-1185082.html
上一篇:纳米粘土辅助的生物水凝胶复杂支架3D打印
下一篇:ACS AMI:通用的3D打印多材料高弹性硅胶方法