博文
BT5:难以捉摸的癌症相关酶的抑制剂
|||
BT5:难以捉摸的癌症相关酶的抑制剂
诸平
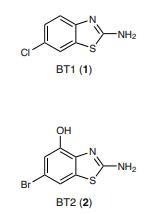
图1 癌症相关酶的抑制剂BTx(x=1, 2, 3, 4, 5, 6)
据密歇根大学的密歇根医学(Michigan Medicine - University of Michigan)2020年8月31日报道,结构生物学技术帮助研究人员首次靶向了与核受体结合的SET结构域家族,因为其故障与几种类型的癌症有关。密歇根大学罗杰尔癌症中心(University of Michigan Rogel Cancer Center)的科学家团队开发了首个药物样化合物,来抑制难以捉摸的癌症相关酶,这些癌症包括了多种侵袭性的儿童白血病等。这种酶-称为组蛋白甲基转移酶(histone methyltransferases)的核受体结合SET结构域(NSD)家族[nuclear receptor-binding SET domain (NSD) family]-长期以来一直是有吸引力的药物靶标,但是以前证明难以攻击它们,因为这些酶中结合位点的形状使得药物样分子很难与之结合。
根据2020年8月31日在《自然化学生物学》(Nature Chemical Biology)上发表的发现,由Tomasz Cierpicki博士和Jolanta Grembecka博士领导的研究团队,他们使用了多种技术,包括X射线晶体学和核磁共振技术,开发出了一种称为NSD1的关键蛋白的一流抑制剂——Huang Huang, Christina A. Howard, Sergei Zari, Hyo Je Cho, Shirish Shukla, Hao Li, Juliano Ndoj, Paula González-Alonso, Caroline Nikolaidis, Joshua Abbott, David S. Rogawski, Mykhaylo A. Potopnyk, Katarzyna Kempinska, Hongzhi Miao, Trupta Purohit, Andrew Henderson, Anna Mapp, Maria Luisa Sulis, Adolfo Ferrando, Jolanta Grembecka, Tomasz Cierpicki. Covalent inhibition of NSD1 histone methyltransferase. Nature Chemical Biology, (2020), DOI: 10.1038/s41589-020-0626-6. Published: 31 August 2020。
该小组将其主要化合物称为BT5,其化学结构式见图1所示。BT5在具有NUP98-NSD1染色体易位的白血病细胞中显示出有希望的活性,这种现象在部分小儿白血病患者中可见。
密歇根大学(UM)的生物物理学和病理学副教授Tomasz Cierpicki说:“我们的研究已经进行了数年,这表明用小分子抑制剂靶向这种关键酶是一种可行的方法。” 这些发现将促进下一代这些酶的有效和选择性抑制剂的开发,这些酶在几种类型的癌症中过度表达、突变或易位。
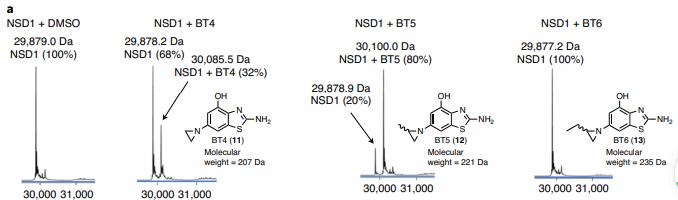
由Tomasz Cierpicki博士和Jolanta Grembecka博士领导的研究团队合作完成的本项研究中,研究者报道了NSD1 HMT的不可逆抑制剂的发展。通过核磁共振片段筛选和化学优化,他们合成了基于结合NSD1固定结构域的2-氨基-4-羟基苯并噻唑骨架的小分子。前人的研究表明,NSD1的SET结构域具有紧凑的自抑制构象,但缺乏适合小分子结合的口袋。在此项研究中,研究者通过共价结合配体确定了NSD1的晶体结构,发现其自抑制环的构象发生了变化,从而形成了一个独特的适合小分子结合的通道状位点。他们所开发的最好的可逆配体是BT2,它与NSD1结合的KD =10.4 μM,并抑制其活性的IC50=66 μM。BT2由于具有相对较低分子质量 (245 Da),因此效力适中,配体效率显著(=0.57),表明与设定结构域具有高质量的相互作用。事实上,共价结合的模拟物BT3的晶体结构表明,2-氨基-4-羟基苯并噻唑骨架与NSD1形成了多种精细的相互作用,包括4个氢键和2个硫键(chalcogen bond,见原文中的图2d)。基于这种晶体结构,他们开发了一类针对C2062自抑制位点的NSD1不可逆抑制剂。成功地将吖啶部分作为一种适合于半胱氨酸共价靶向弹头埋在疏水位点。共价先导化合物BT5,在低微摩尔浓度(μM)下抑制NSD1,并显示与细胞内NSD1 SET区域的结合,在不干扰H3K36me3的情况下,H3K36me2水平整体降低。有趣的是,尽管C2062在所有三个NSD SET区域中都保守,但研究者观察到BT5对NSD1的选择性增强,特别是在CETSA实验中。用BT5处理NUP98 - NSD1转化细胞,导致细胞生长受到抑制,并与HoxA基因下调相关,验证了其靶向作用机制。BT5损害了含有NUP98-NSD1的原发性AML细胞的集落形成,但不影响MLL-ENL易位,也不影响正常CD34+祖细胞的集落形成。
虽然BT5证明了用小分子靶向NSD蛋白的固定结构域是可行的,但这是一种活性可与第一代共价K-Ras抑制剂相比的工具化合物。需要进一步优化来开发NSD1化学探针和BT5的药物类似物。其中一种改进可以是取代吖啶部分来减弱反应性,从而提高细胞的选择性。不过,这项工作已经提供了一种有价值的先导化合物(BT5),它可以可逆和不可逆地结合到NSD SET的所有三个区域,尽管活性不同,但对NSD1表现出明显的偏好。具有共价结合配体的NSD1晶体结构将会促进下一代HMTs NSD家族的强选择性抑制剂的开发。更多信息请注意浏览原文或者相关报道。
Abstract
The nuclear receptor-binding SET domain (NSD) family of histone methyltransferases is associated with various malignancies, including aggressive acute leukemia with NUP98-NSD1 translocation. While NSD proteins represent attractive drug targets, their catalytic SET domains exist in autoinhibited conformation, presenting notable challenges for inhibitor development. Here, we employed a fragment-based screening strategy followed by chemical optimization, which resulted in the development of the first-in-class irreversible small-molecule inhibitors of the nuclear receptor-binding SET domain protein 1 (NSD1) SET domain. The crystal structure of NSD1 in complex with covalently bound ligand reveals a conformational change in the autoinhibitory loop of the SET domain and formation of a channel-like pocket suitable for targeting with small molecules. Our covalent lead—compound BT5—demonstrates on-target activity in NUP98-NSD1 leukemia cells, including inhibition of histone H3 lysine 36 dimethylation and downregulation of target genes, and impaired colony formation in an NUP98-NSD1 patient sample. This study will facilitate the development of the next generation of potent and selective inhibitors of the NSD histone methyltransferases.
https://blog.sciencenet.cn/blog-212210-1248875.html
上一篇:世界名校(Top200)撤稿知多少
下一篇:类固醇药物可拯救重症新冠患者的生命