博文
由 “格列卫 — 一个转化医学的世纪典范”的前世今生说开去
|||
由 “格列卫 — 一个转化医学的世纪典范”的前世今生说开去
刘乔飞
北京协和医院基本外科
前言
格列卫,是诺华制药公司(Novartis)研发的一种针对酪氨酸激酶BCR-ABL的分子靶向药物,现作为费城染色体 (Philadelphia chromosome)阳性的慢性粒细胞白血病(Chronic myelogenous leukemia,CML)的一线用药,有效率高达95%,且用于治疗胃肠道间质瘤(Gastrointestinal stroma tumor, GIST)也取得了确切疗效。格列卫是“甲磺酸伊马替尼(Imatinib Mesilate)”在中国大陆的商品音译名,其在欧、澳及南美洲被称为“Glivec”,在美国则被称为“Gleevec”。格列卫在治疗CML与GIST上的巨大成功,引起了医学界和科学界的极大关注,2011年汤母森的诺贝尔奖得主预测更是将格列卫排在生理学奖及医学奖榜首。然而,很少有人知道,从1960年格列卫的作用靶点“费城染色体”的发现算起,直到2001年5月及2002年2月美国FDA分别批准格列卫应用于CML及GIST的治疗,时间跨越了约半个世纪,且是为数不多的仅通过了I期临床,就以“绿色通道”形式直接获批的临床一线新药。更少有人知道在格列卫的孕育过程中,直接或间接造就了两项“世界第一”(首次发现肿瘤细胞中的染色体变异;首次发现染色体易位现象),5位美国科学院院士,5位Lasker临床医学研究奖得主(美国的诺贝尔奖)以及1位美国国家自然科学奖得主(类似我国的最高科学技术奖)。而格列卫本身凝聚着多个国家几代肿瘤学家、药学家、临床医学家的共同智慧,更是基础研究所、药物研发公司、临床医疗中心密切合作造就的转化医学的世纪经典。
1. 费城染色体的庐山真面目
上世纪50、60年代,当时“病毒是引起肿瘤的主要原因”的观点炙手可热,更是被主流学术界所认可,而这时宾西法利亚大学肿瘤研究所的Nowell和Hungerford正在做一项被认为“离经叛道”的事情,他们正试图寻找肿瘤细胞中遗传物质的改变。1956年, Nowell在研究CML细胞过程中发现肿瘤细胞染色体数目多于正常组织,但由于他本人非遗传学科班出生,于是他找到了另一位研究染色体的同事Hungerford来共同研究这一现象。1960年,他们证实在CML肿瘤细胞内存在一条小染色体,而为了纪念他们工作所在的城市,把这条小染色体命名为费城染色体,发表在《Science》[1]。(注:当时他们认为费城染色体为一条额外的小染色体,后来证实其并非额外的染色体。实际上直到他们发表论文3年后,人类的染色体准确数目才被确定为46条,所以他们的实验结果也不能算是真正的错误。该篇论文也是世界上首次报道肿瘤与染色体变异存在关系的文章。该篇论文在1985年就被引用了超过510次,被ISI评为周经典论文(This week’s citation classic)。2001年该论文还被Nature 评为1889-2001年的里程碑式论文之一,目前为止被引用1807次。)他们的发现得到了多数人的认可 ,但其他科学家还是认为费城染色体只是肿瘤导致的结果而不是引起肿瘤的原因。由于费城染色体的本质不清,导致在相当长的一段时间内,费城染色体的研究裹足不前。直到13年后,芝加哥大学的Rowley等利用喹吖因荧光以及GIEMSA染色技术发现22号染色体的缺失的长度刚好等于9号染色体多出来的长度,于是她认为费城染色体是22号染色体长臂一部分与9号染色体长臂一分部易位的结果,该篇论文已通讯的形式发表在《Nature》[2]。(注:被引用1973次,为首次报道染色体易位现象)人们虽然明白了费城染色体为染色体易位所致,但尚不清楚其具体功能,仍然怀疑其是不是直接导致CML的原因。直到上世纪80年代,随着癌基因研究的兴起,新西兰科学家Annelies等发现人与小鼠白血病病毒的一段同源基因序列(C-ABL)从9号染色体易位到了22号染色体长臂上,这一结论表明C-ABL的易位导致了CML。1982年这篇论文同样以通讯的形式发表在《Nature》[3]。(注:被引用936次)。而后的研究表明费城染色体为9号染色体长臂(9q34)上的原癌基因ABL和22号染色体(22q11)上的BCR(染色体易断裂区)基因重新组合成融合基因后,使酪氨酸激酶活性持续升高,从而导致了CML,论文于1984年发表在《cell》[4]。(注:被引用1147次)从1960年,Nowell发现费城染色体,到1973年Rowley明确费城染色体为染色体易位所致,最后到1982年Annelies发现癌基因C-ABL易位后与BCR融合使酪氨酸激酶持续激活,最终导致了CML的发生,共经历了22年。这一曲折的过程中,Nowell首次发现肿瘤与染色体变异直接相关,Rowley首次发现染色体易位现象。这样的成果,让Nowell与Rowley蜚声国际学术界。1976年、1984年Nowell和Rowley分别被推选为美国科学院院士。1998年,他们与“二次打击“学说的提出者Knudson一同获得了享有美国诺贝尔奖之称的Lasker 临床医学研究奖,且Rowley在同一年被美国总统授予 国家科学奖(类似我国的最高科学技术奖),2009年被授予总统自由勋章(Presidential Metal of Freedom)(美国民众的最高荣誉)。 至此,费城染色体导致CML的作用机制已经阐明,而有两位两位极富远见的年轻人,有着更大的梦想,那就是针对费城染色体融合基因BCR-ABL设计靶向药物,从而特异性的杀灭肿瘤细胞。
2. 从STI-571到Sunitinib
1984年,也就是发现BCR-ABL融合基因的同一年,年仅29岁的Druker在完成肿瘤科住院医师培训后感受到了传统化疗的局限性,随着生物化学、分子生物学和基因组学的兴起,他预感到新的肿瘤治疗模式即将诞生,于是怀揣着致力于开发靶向杀灭肿瘤细胞治疗药物的梦想来到了哈佛医学院的Dana-Farber 肿瘤研究所。(注:1988年后,Druker到了俄勒冈健康与科学大学肿瘤研究所,参见2009年纽约时报对Druker的采访)然而,直到1988年,Druker的研究工作未取得实质性的进展。然而就在此时,峰回路转,Ciba-Geigy制药公司的英国籍研究员Lydon在与Druker的一次交谈中谈到想致力于研发针对肿瘤细胞特异性酶杀灭肿瘤细胞的药物,而Druker向Lydon建议CML的BCR-ABL是最佳选择。于是一个研究型临床肿瘤医生与一个药物学家的合作就此展开了。后来的几年中,Lydon通过高通量的药物设计筛选方法选出了一系列的化合物,然后寄给Druker进行测试。在这一系列的化合物中,Druker发现一个名为STI-571的2-苯胺基嘧啶衍生物在体内和体外均可以明显表达抑制表达BCR-ABL的细胞。STI-571(最开始被称为 CGP 57148B)可抑制92-98%的来源于CML患者的肿瘤细胞在体外形成集落,然而对正常细胞影响极小。完成了细胞学试验后,他们进一步完成了动物的体内试验,其安全性和有效性均得到了证实[5-10]。于是1995年,STI-571作为最佳备选药物准备进入I期临床试验。然而,1996年,风云突变,汽巴-嘉基公司(Ciba-Geigy)和山德士公司(Sandoz)宣布合并,成立诺华公司(Novartis),再加上绝大多数人认为STI-571在抑制BCR-ABL的同时会抑制其他生理性酪氨酸激酶,从而产生严重毒副作用,STI-571面临被停止试验的命运。最终在Druker的游说下,诺华的高层同意进行I期临床试验。1998年,纪念斯隆-凯特林癌症中心的Sawyers和安德森癌症中心 MosTalpaz与Druker一起指导了STI-571的I期临床试验。该试验共纳入83例干扰素治疗失败的CML患者,结果表明其具有强大的抗CML作用,且绝大数患者对STI-571耐受良好,发表在2001年的《NEJM》[11]。(注:被引用3163次)同年,当时洛克菲勒大学的生物物理学家Kuriyan也阐明了STI571抑制BCR-ABL的生物物理机制,发表在当年的《Science》和次年的《Cancer Research》上[12,13]。(注:分别被引用了1193次和569次)鉴于STI-571的确切疗效,美国FDA罕见的在STI-571还没有进行III期临床的情况下就于2001年5月批准了STI-571用于CML的一线治疗(注册商品名为“Gleevec”,中译名“格列卫”,专利权为诺华公司所有)。而直到2002年,由Sawyers和Druker引导的STI-57对急变期CML的II期临床试验才完成,论文发表在《BLOOD》[14]。(注:引用901次)随后,Druker又领导了对GLEEVEC用于CML治疗的5年随访,结果表明其疗效远好于干扰素+阿糖胞苷的传统方案,发表在2006年的《NEJM》[15]。(注:被引用902次,Sawyers与Talpaz未署名)。至此,经过高通量筛选得到的STI-571再经历了细胞学实验、动物实验和I期临床后,以“绿色通道”的形式,获得了FDA的批准,快速直接用于CML的一线治疗,同时其生物物理作用机制也得到了阐明。在这一过程中,诺华公司的研究员Lydon从Dana-Farber 肿瘤研究所的Druker那里得到灵感,并最终合作成功合成了STI-571,而Druker负责STI-571的实验室研究、制定及协作临床研究方案,而纪念斯隆-凯特林癌症中心的Sawyers和安德森癌症中心Talpaz则是STI-571 I期临床试验的实际策划者和最主要执行者,在STI571已经取得临床成功的同时,洛克菲勒大学的生物物理学家Kuriyan完成了其生物物理学作用机制的阐释。
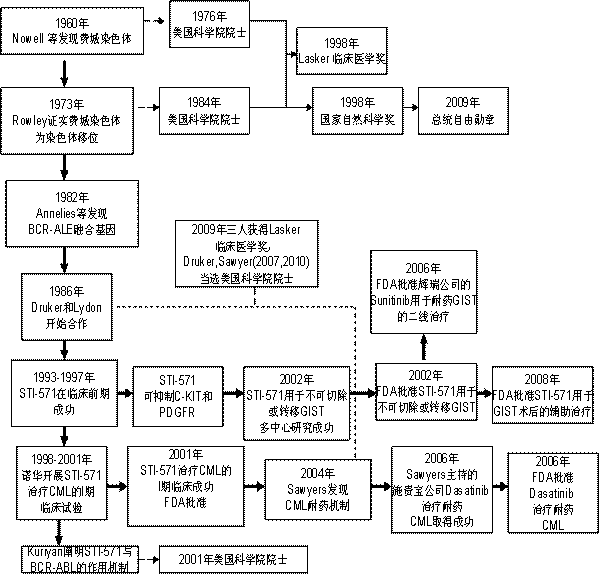
从1960年“费城染色体”发现,到2008年FDA批准“格列卫”用于GIST手术切除后的辅助治疗,经历约半个世纪。格列卫的这半个世纪大概可以分为三个阶段:第一阶段:. 发现BCR-ABL:1960年Nowell发现费城染色体;1973年Rowley确定费城染色体为9号染色体与22号染色体的易位;1982年Annelies证实易位产生的BCR-ABL融合基因为导致CML的原因。第二阶段:STI-571的成功,包括4个标志性事件:1.1994年,LYDON与Druker合成STI-571;2.1994-1998年,临床前期实验取得巨大成功;3.2001年,I期临床取得巨大成功,获得FDA批准作为治疗CML和不可切除或转移GIST的一线药物;4.2001年-2002年,Kuriyan阐明STI-571与BCR-ABL作用的生物物理机制。第三阶段:拓展阶段:1. Sawyers阐明CML肿瘤细胞耐药的分子机制,并联合百时美施贵宝制药公司成功合成Dasatinib;2. Dasatinib 的I期临床试验取得巨大成功,同年获得FDA批准作为格列卫耐药的 CML的二线用药;3. Demetri领导完成辉瑞制药公司Sunitinib治疗格列卫耐药的不可切除或转移GIST临床试验,取得巨大成功,2006年获得FDA批准作为二线用药;4. 2008年,FDA批准格列卫用于GIST手术切除后的辅助治疗。(图一)
我们看到了在这一波澜壮阔的半个世纪中一个实验室发现如何随着科学技术的发展一步一步走出实验室,在科研院所、药物研发公司与大型临床医疗中心的协作下,最后创造了无数的生命奇迹,造就了一大批学术巨擘,创造了每年数十亿美元的经济价值。随着上世纪80年代开始,分子生物学、遗传学、生物物理学等基础学科的迅猛发展,以及我国对基础研究持续多年的巨大投入,已产生了一批极富潜力的重大疾病的预防、治疗靶点,而这些潜在的新“费城染色体”如何再次走出实验室,成功走向临床,再次创造生命的奇迹,造就我国新一代学术巨匠、发展具有我国自主知识产权的新药,创造更大的经济社会效益,成为我国医学科学事业厄待解决的难题。
参考文献
1. Nowell P C, Hungerford DA. A minute chromosome in human chronic granulocytic leukemia. Science, 1960, 132:1488–1501.
2. Rowley JD. A new consistent chromosomal abnormality in chronic myelogenous leukaemia identified by quinacrine fluorescence and Giemsa staining. Nature, 1973, 243:290–293
3. de Klein A, van Kessel AG, Grosveld G et al. A cellular oncogene is translocated to the Philadelphia chromosome in chronic myelocytic leukaemia. Nature, 1982, 300: 765–767.
4. Groffen J, Stephenson JR, Heisterkamp N, et al. Philadelphia chromosomal breakpoints are clustered within a limited region, bcr, on chromosome 22 . Cell, 1984, 36(1):93-99.
5. Druker BJ, Tamura S, Buchdunger E, et al. Effects of a selective inhibitor of the Abl tyrosine kinase on the growth of BCR-ABL positive cells. Nature Med, 1996, 2: 561-566.
6. Zimmermann J, Buchdunger E, Mett H, et al. Potent and selective inhibitors of the Abl-kinase: phenylamino-pyrimidine (PAP) derivatives. Bioog. Med Chem Lett, 1997, 7:187-192.
7. Gambacorti-Passerini C, le Coutre P, Mologni L, et al. Inhibition of the ABL kinase activity blocks the proliferation of BCR/ABL+ leukemic cells and induces apoptosis. Blood Cells Mol Dis, 1997, 23:380-394.
8. Buchdunger E, Zimmermann J, Mett H, et al. Selective inhibition of the platelet-derivedgrowth factor signal transduction pathway by a protein-tyrosine kinase inhibitor of the 2-phenylaminopyrimidine class. Proc Natl Acad Sci USA, 1995, 92:2558–2562.
9. Buchdunger E, Zimmermann J, Mett H. Inhibition of the Abl protein-tyrosine kinase in vitro and in vivo by a 2-phenylaminopyrimidine derivative. Cancer Res, 1996, 56:100–104.
10. Deininger MW, Goldman JM, Lydon N, et al. The tyrosine kinase inhibitor CGP57148B selectively inhibits the growth of BCR-ABL-positive cells. Blood, 1997, 90:3691–3698.
11. Druker BJ, Talpaz M, Resta DJ, et al. Efficacy and Safety of a Specific Inhibitor of the BCR-ABL Tyrosine Kinase in Chronic Myeloid Leukemia. N Engl J Med, 2001, 344(14):1031-1037.
12. Schindler T, Bornmann W, Pellicena P, et al. Structural mechanism for STI-571 inhibition of abelson tyrosine kinase. Science, 2000, 289(5486):1938-1942.
13. Shah NP, Nicoll JM, Nagar B, et al. Multiple BCR-ABL kinase domain mutations confer polyclonal resistance to the tyrosine kinase inhibitor imatinib (STI571) in chronic phase and blast crisis chronic. Cancer Cell, 2002, 2(2):117-125.
14. Talpaz M, Silver RT, Druker BJ, et al. Imatinib induces durable hematologic and cytogenetic responses in patients with accelerated phase chronic myeloid leukemia: results of a phase 2 study. Blood, 2002, 99(6):1928-1937.
15. Druker BJ, Guilhot F, O'Brien SG, et al. Five-year follow-up of patients receiving imatinib for chronic myeloid leukemia. N Engl J Med, 2006, 355(23):2408-2417.
16. Gorre ME, Mohammed M, Ellwood K, et al. Clinical resistance to STI-571 cancer therapy caused by BCR-ABL gene mutation or amplification. Science, 2001, 293:876-880.
17. Shah NP, Nicoll JM, Nagar B, et al. Multiple BCR-ABL kinase domain mutations confer polyclonal resistance to the tyrosine kinase inhibitor imatinib (STI571) in chronic phase and blast crisis chronic myeloid leukemia. Cancer Cell, 2002, 2:117-125.
18. Shah NP, Tran C, Lee FY, et al. Overriding imatinib resistance with a novel ABL kinase inhibitor. Science, 2004, 305: 399-401.
19. Talpaz M, Shah NP, Kantarjian H, et al. Dasatinib in imatinib-resistant Philadelphia chromosome-positive leukemias. N Engl J Med, 2006, 354: 2531-2541.
20. Heinrich MC, Griffith DJ, Druker BJ, et al.Inhibition of c-kit receptor tyrosine kinase activity by STI 571, a selective tyrosine kinase inhibitor. Blood, 2000, 96(3):925-932.
21. Buchdunger E, Cioffi CL, Law N, et al. Abl protein-tyrosine kinase inhibitor STI571 inhibits in vitro signal transduction mediated by c-kit and platelet-derived growth factor receptors. J Pharmacol Exp Ther, 2000, 295(1):139-145.
22. Joensuu H, Roberts PJ, Sarlomo-Rikala M, et al. Effect of the tyrosine kinase inhibitor STI571 in a patient with a metastatic gastrointestinal stromal tumor. N Engl J Med, 2001, 344(14):1052-1056.
23. Demetri GD, von Mehren M, Blanke CD, et al. Efficacy and safety of imatinib mesylate in advanced gastrointestinal stromal tumors. N Engl J Med, 2002, 347(7):472-480.
24. Heinrich MC, Corless CL, Duensing A, et al. PDGFRA activating mutations in gastrointestinal stromal tumors. Science, 2003, 299(5607):708-710.
25. Heinrich MC, Corless CL, Demetri GD, et al. Kinase mutations and imatinib response in patients with metastatic gastrointestinal stromal tumor. J Clin Oncol , 2003, 21(23):4342-4349.
26. Demetri GD, van Oosterom AT, Garrett CR, et al. Efficacy and safety of sunitinib in patients with advanced gastrointestinal stromal tumour after failure of imatinib: a randomised controlled trial. Lancet, 2006, 368(9544):1329-38.
27. Dematteo RP, Ballman KV, Antonescu CR, et al. Adjuvant imatinib mesylate after resection of localised, primary gastrointestinal stromal tumour: a randomised, double-blind, placebo-controlled trial. Lancet, 2009, 373(9669):1097-1104.
https://blog.sciencenet.cn/blog-209648-666353.html