博文
间断节食 加速心血管疾病《自然》  精选
精选
|
间断节食通过大量动员中性粒细胞加速心血管疾病《自然》
周期饮食是否增加了你患心脏病的风险?在老鼠身上,交替的高脂肪和低脂肪饮食通过调节身体的先天免疫反应促进了动脉中的斑块积累。虽然和人类是否类似仍然需要研究。如果人类也是如此,减肥或减少脂肪摄取饮食,要么持续坚持,要么干脆不要进行,三天打鱼两天晒网的减肥可能会增加动脉硬化的可能性。
饮食与心血管疾病之间的关系已经被研究了几十年,并已得到广泛认可,然而关于心血管健康的最佳饮食仍然存在相当大的争议1,2。科学家们对于动脉粥样硬化的理解——一种血管中脂肪斑块的积累,是心血管疾病的主要原因——大多来自持续暴露于高脂饮食的小鼠研究。然而,在现实生活中,人们的饮食随时间变化,而“悠悠球式”节食非常普遍。尽管有猜测称这种在饮食之间来回切换的模式及由此导致的体重变化对健康不利3,但缺乏有说服力的数据,其机制也尚未被充分理解。发表在《自然》杂志上的两项独立且互补的研究4,5探讨了在高脂饮食和低脂饮食之间循环的影响,并且都发现,令人惊讶的是,与持续的高脂饮食相比,饮食循环显著增加了动脉粥样硬化的程度。这些研究支持了悠悠球式节食可能对心脏有害的观点,并提供了可能加速心血管疾病的机制见解。
动脉粥样硬化是一种慢性炎症状况,其中胆固醇和免疫细胞在动脉壁中积聚,最终导致斑块、血流阻塞和心脏病发作。研究动脉粥样硬化的一个常见模型是对遗传工程改造以倾向于高胆固醇水平并喂食持续高脂饮食以提升胆固醇水平的小鼠。Lavillegrand等人和Takaoka等人的研究独立设计,检验了交替高脂饮食对血胆固醇和动脉粥样硬化的影响。
Alternating high-fat diet enhances atherosclerosis by neutrophil reprogramming | Nature (sjuku.top)
这两项研究中的饮食循环方案明显不同。Lavillegrand及其同事给六周大的小鼠(大约相当于人类的青春期)喂食四周的高脂饮食,接着是八周的标准鼠粮(饲料),然后再是四周的高脂饮食。作者将这种“长期交替”饮食的结果与那些在前八周喂食正常饲料,然后在最后八周喂食持续高脂饮食的小鼠进行了比较。Takaoka及其同事也是从六周大开始喂食高脂饮食,但他们使用了六次一周的高脂饮食,接着两周的饲料——“频繁间歇”饮食。他们将这些小鼠与一个对照组进行了比较,该对照组在前十周喂食饲料,然后六周喂食高脂饮食。
值得注意的是,在这两项研究中,喂食循环高脂饮食的小鼠与喂食持续高脂饮食的对照动物相比,动脉粥样硬化程度大幅增加。Takaoka等人注意到,这种效应在雄性中比雌性更为显著,而Lavillegrand等人发现雄性和雌性受到的影响相似。值得注意的是,在两项研究中,对照组和交替饮食组之间的体重和血液中的胆固醇水平(也称为累积胆固醇负担)没有差异。此外,肠道驻留微生物的变化不能解释动脉粥样硬化的差异。这些结果表明,增加动脉粥样硬化的潜在机制可能不是由于传统风险因素或肠道微生物群的暴露。
尽管间歇性高脂饮食组与持续高脂饮食组之间的累积血液胆固醇负担无差异,间歇性高脂饮食如何促进动脉粥样硬化的急剧增加呢?动脉粥样硬化的特点是对动脉壁中脂质积累的免疫反应,以前的报告已经表明饮食与免疫反应之间存在关系6。鉴于此,两个研究小组探索了高脂饮食循环可能如何影响系统性免疫反应。
在机制洞察方面,这两项研究在此分道扬镳。在排除了脾脏中一种叫做淋巴细胞的白细胞的贡献以及适应性(获得性)免疫系统的反应后,Lavillegrand等人专注于描述属于先天免疫系统分支的白细胞——中性粒细胞的作用。一旦小鼠开始高脂饮食,血液中的中性粒细胞水平就会增加,而在切换到饲料后则会减少。引人注目的是,当第二次高脂饮食周期开始时,与首次暴露相比,血液中的中性粒细胞计数增加了五倍多——这种差异在其他免疫细胞反应中并未见到。
循环中性粒细胞的增加与血液中称为趋化因子的小信号蛋白的水平增加相对应,这些小信号蛋白参与吸引中性粒细胞到炎症部位。研究人员还看到了促炎性中性粒细胞的富集,他们通过从一种叫做主动脉的大动脉的组织进行单细胞RNA测序来识别这些细胞。当研究人员耗尽中性粒细胞时,高脂饮食循环加速动脉粥样硬化的效果被消除了,这意味着中性粒细胞在这一现象中具有因果作用。
接下来,Lavillegrand及其同事从喂食高脂饮食的小鼠中采集骨髓,并将其移植到全身照射破坏骨髓(因此也破坏了发育中的免疫细胞)的小鼠体内。作者发现,与来自对照小鼠的骨髓相比,来自喂食高脂饮食的小鼠的骨髓导致了显著增加的动脉粥样硬化。
进一步的实验表明,重新暴露于高脂饮食促进了一种称为紧急髓系生成的过程,在这个过程中,一个急性加重的刺激(例如感染或伤害)迅速刺激先天免疫反应。重新暴露于高脂饮食导致产生了释放炎症蛋白IL-1β的未成熟中性粒细胞,IL-1β在炎症性心脏病中有着明确的作用7。抑制IL-1β或NLRP3炎症体——一种涉及激活IL-1β的蛋白质复合物,逆转了加速的动脉粥样硬化,强调了IL-1β依赖的中性粒细胞前体细胞重编程的重要性。
相比之下,Takaoka等人专注于另一种称为巨噬细胞的先天免疫细胞的作用。受到已知动脉巨噬细胞在调节动脉粥样硬化过程中的作用的启发,作者对在频繁间歇高脂饮食和持续高脂饮食喂养方案下的小鼠主动脉组织进行了RNA测序。他们在仅暴露三周后取样,当时两组之间的斑块大小相似。基因表达谱表明,间歇性高脂饮食导致组织常驻巨噬细胞减少,这些巨噬细胞被认为执行保护免受动脉粥样硬化的自身稳定功能8。事实上,作者发现了受损的细胞过程,称为自噬(细胞碎片的回收利用)和胞葬作用(吞噬死亡细胞),这些过程对抵御动脉粥样硬化有保护作用。
删除编码促进组织常驻巨噬细胞功能的转录因子SPIC的基因,导致在持续高脂饮食上更多的动脉粥样硬化,并消除了间歇性高脂饮食的加速效应。因此,在间歇性高脂饮食暴露下,保护性的常驻动脉巨噬细胞数量减少并且失去了它们的保护功能,导致更大、更先进的动脉粥样硬化斑块。
尽管这两项研究都集中在先天免疫系统上,但值得注意的是,Takaoka等人没有调查中性粒细胞的贡献,而Lavillegrand也没有研究巨噬细胞。两种途径都可能对间歇性高脂饮食加速动脉粥样硬化的效果有所贡献(图1)。此外,这两项研究都没有触及循环高脂饮食改变免疫细胞特征从而加速动脉粥样硬化的基本分子机制的核心。
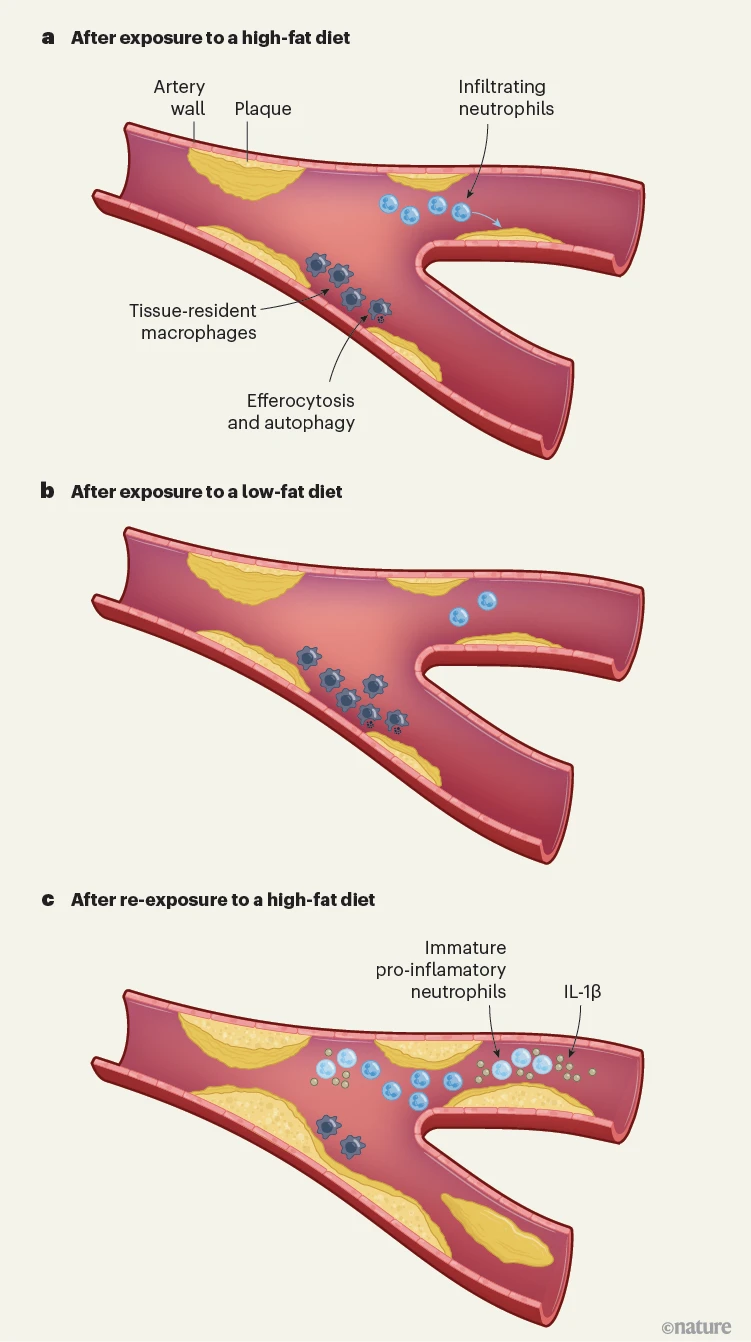
图1 | 间歇性高脂饮食对动脉的影响。Lavillegrand等人4和Takaoka等人5研究了饮食循环对动脉粥样硬化的影响——在动脉壁积累脂肪斑块。a,在暴露于高脂饮食的年轻小鼠的动脉中,斑块开始发展。被称为中性粒细胞的循环免疫细胞渗入动脉壁并促成动脉粥样硬化。居住在动脉壁中的被称为巨噬细胞的免疫细胞介导清除细胞碎片的过程(自噬和胞葬作用),保护免受动脉粥样硬化。b,当小鼠暴露于低脂饮食几周时,斑块水平保持不变,但中性粒细胞减少而组织常驻巨噬细胞增加。c,重新暴露于高脂饮食导致中性粒细胞大幅增加,包括从骨髓释放的不成熟、促炎性的中性粒细胞,它们产生炎症蛋白白细胞介素(IL)-1β。此外,组织常驻巨噬细胞被耗尽,意味着保护过程无法高效进行。这两种机制在高脂饮食循环期间都促成了加速的动脉粥样硬化。
这些在小鼠身上的结果是否与人类相关?除了一些例外,许多源自小鼠动脉粥样硬化的洞见在人类身上也成立,但这些小鼠研究结果外推到人类必须谨慎进行。Takaoka等人包括了一项大型前瞻性研究的观察性人类数据,该研究评估了血液胆固醇暴露对成年后期动脉粥样硬化斑块数量的影响。他们发现,早期生活(儿童期和青少年期)的胆固醇暴露增加了成年期的动脉粥样硬化。数据对作者的发现提供了适度支持,但远非结论性的。将人类分配到循环或间歇性高脂饮食的实验研究会是一个更直接的测试。尽管在这种设定下评估动脉粥样硬化可能不切实际,因为它需要很长时间才能发展出动脉粥样硬化,但可以监测其他免疫激活和炎症的标志物作为替代。
IL-1β作为间歇性高脂饮食效应的潜在介质的含义很有趣,因为有强有力的证据表明IL-1β途径促进动脉粥样硬化性心血管疾病。事实上,一项针对抑制IL-1β的疗法的大型临床试验显示了临床心血管事件的减少9。
总的来说,这些研究强调了饮食模式对先天免疫系统及其在动脉粥样硬化中的作用的深远影响。这些发现强调了早期和持续的风险因素干预的重要性,并为预防动脉粥样硬化性心血管疾病的机制和潜在治疗目标提供了新的见解。
https://blog.sciencenet.cn/blog-41174-1452548.html
上一篇:氢气对人类脂肪组织的直接效应研究
下一篇:疑似妇科论文窝案!130篇问题论文含同一作者