博文
阿尔茨海默病和疯牛病是同类疾病!!
||
近期研究显示,关于阿尔茨海默病(Alzheimer's disease, AD)起源的争论可能即将结束,其主导机制与朊病毒疾病中错误折叠蛋白的“播种”聚集现象有着明显的相似性。朊病毒疾病是一类进行性的、致命的神经退行性疾病,在人类中包括克雅氏病(Creutzfeldt-Jakob disease)、库鲁病(kuru)、格斯特曼-施特劳斯勒-谢因克综合征(Gerstmann-Sträussler-Scheinker syndrome)和致命性失眠症(fatal insomnias)。这些疾病的发生是由于朊蛋白(PrP)错误折叠并迫使正常的PrP分子也变成同样自我传播的错误折叠形状(1)。由此产生的蛋白质颗粒——朊病毒——可以作为传染源,将疾病从一个有机体传播到另一个有机体,且具有较长的潜伏期。感染性朊病毒疾病在一些非人类物种中很常见,但人类的朊病毒疾病大多是特发性或遗传性的,起源于受感染个体内部朊病毒的形成和传播。无论其起源如何,所有朊病毒疾病都源自同一基本过程:PrP的结构腐化和“播种”聚集。
朊病毒具有多种促进其致病性的特性。它们由宿主编码的蛋白质组成,这些蛋白质通过类似于结晶的过程使其他PrP分子错误折叠并传播。朊病毒的大小和形状各异,不同的三维构型影响其致病特性(即所谓的株系现象)。它们还能抵抗大多数微生物和病毒的中和剂,如热和甲醛。它们在大脑内系统性传播,并且可以从中枢神经系统外部侵入大脑。
阿尔茨海默病的病理特征是两种错误折叠蛋白聚集体的存在:细胞外的β-淀粉样蛋白(amyloid-β, Aβ)斑块和细胞内的tau蛋白在神经纤维缠结中。随着阿尔茨海默病的发展,大脑会出现许多其他变化,这些变化助长了关于聚集蛋白,尤其是Aβ在驱动疾病中的相对重要性的争论。遗传学和生物标志物证据越来越明确地表明,Aβ是阿尔茨海默病最早的定义特征(2, 3)。然而,错误折叠的Aβ在大脑中增殖的分子机制一直不确定。
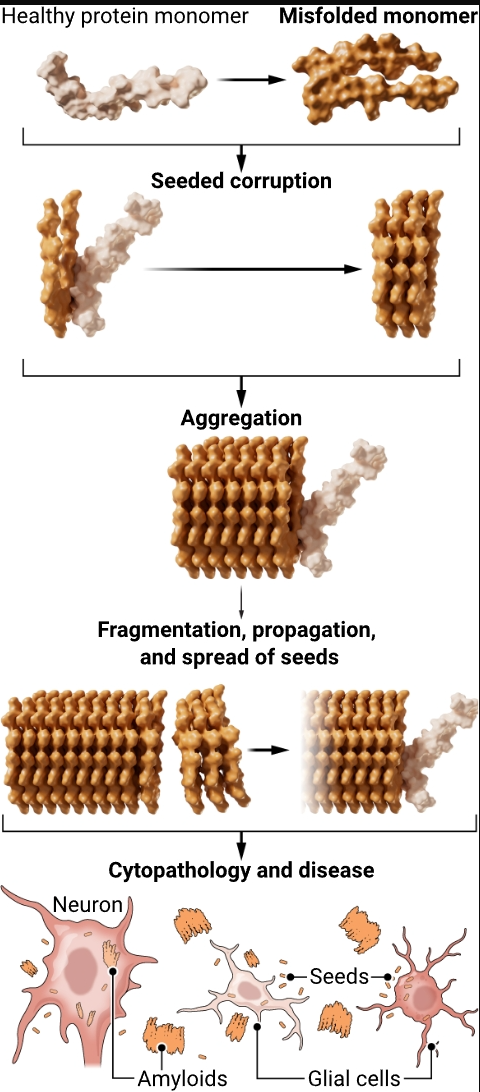
小鼠模型的研究表明,大脑中的Aβ以本质上与朊病毒疾病中PrP的“播种”增殖相同的方式被诱导聚集和传播(见图)。Aβ种子由交替折叠的宿主编码蛋白组成,这些蛋白结构上破坏了原始的Aβ分子。它们的大小和形状各异,后者赋予其类似株系的特性。这些种子能够抵抗热和化学灭活,并在大脑内外传播(4)。值得注意的是,像Aβ蛋白病一样,tau蛋白病也是由于类似朊病毒的蛋白质错误折叠和“播种”聚集的分子过程引起的(5)。然而,小鼠并未发展出人类阿尔茨海默病所具备的全部三个特征——即Aβ斑块、神经纤维缠结和可归类为痴呆的行为障碍。因此,直接证据表明Aβ的“播种”聚集能导致人类阿尔茨海默病一直缺乏。
这种情况开始改变,当一种称为Aβ型脑淀粉样血管病的疾病在多年前暴露于人体垂体激素或来自人类尸体的硬脑膜的人中被报道时(6, 7)。一些批次的这些生物材料被证明被Aβ种子污染(8),这些种子很可能来源于死亡时正在潜伏Aβ病理(阿尔茨海默病和/或脑淀粉样血管病)的供体。尽管在这些激素制剂中也检测到了tau蛋白(8),但大多数获得性淀粉样血管病病例几乎没有或完全没有tau蛋白病变,这表明材料中缺乏或没有能够播种的tau蛋白。没有任何患者表现出阿尔茨海默病的全部临床病理特征。
最近,研究人员报告了一组在儿童时期接受过从尸体分离的人生长激素治疗的受试者。三十多年后,他们表现出阿尔茨海默病的临床和/或病理特征,包括Aβ斑块、神经纤维缠结和早期痴呆(9)。这些案例的复杂历史要求我们在推断因果关系时保持谨慎,但在异常早的年龄出现认知衰退以及阿尔茨海默病的定义性病变或生物标志物支持了一个初步结论,即一种类似朊病毒的机制在起作用。
阮病毒原理
正常生成的蛋白质折叠成一种替代分子结构,通过结构性地腐蚀同源蛋白质分子自我增殖。这些错误折叠的分子自组装成多聚体,然后通过分裂、传播和扩散来增殖,导致细胞病理变化,从而促成了最终的疾病。蛋白质可以折叠成不同的变种,根据蛋白质的不同,增殖可能发生在细胞外和/或细胞内。在许多但不是所有情况下,被破坏的蛋白质聚集在一起形成被称为淀粉样蛋白的病变。
随着1985年重组生长激素的引入,那些促成获得性阿尔茨海默病的非凡病例的条件已经基本消失,重要的是要强调,在日常生活环境下,阿尔茨海默病是不可传染的。鉴于涉及案例的临床和病理复杂性,前述发现接受生长激素治疗的儿童后来发展出阿尔茨海默病的特征(9)本身并不决定性地证明疾病的传播。实际上,人类传播的确切证据可能是无法获得的。然而,基于先前的实验、遗传和生物标志物研究,以及许多关于人类获得性脑淀粉样血管病的报道,这一发现增加了越来越令人信服的证据,表明阿尔茨海默病起源于Aβ的类阮病毒错误折叠和种子聚合。
疾病扩展阮病毒原理具有实际和理论上的含义。通过将注意力集中在种子蛋白聚合的核心过程上,阮病毒原理有助于精炼和聚焦诊断和治疗策略,特别是在疾病的早期阶段,当干预可能产生最大影响时(10, 11)。预防方法将从更充分理解如何风险因素如年龄增长促进和维持蛋白病理种子的产生和传播中受益。还需要更深入理解菌株现象和种子Aβ聚合的众多病理表现,因为这些可能包括有效的治疗目标。例如,需要特别注意Aβ蛋白病理学与tau病理学之间的联系,同样也要注意炎症作为Aβ蛋白病理学的风险因素和反应。此外,阿尔茨海默病和脑淀粉样血管病的潜在可传播性提醒我们,使用人体来源的生物制剂应包含防止接收者暴露于蛋白病理种子的安全措施(12)。
越来越多的证据表明,特定蛋白的类阮病毒种子聚合涉及许多其他神经和非神经系统疾病(1, 4, 13)。除了阿尔茨海默病,这些疾病还包括帕金森病和路易体痴呆,它们以α-突触核蛋白的聚集为特征;多种tau病理和非神经性淀粉样蛋白病;肌萎缩侧索硬化-额颞叶痴呆谱系障碍;亨廷顿病;可能还有更多。尽管这些疾病以不同的方式表现出来,但类阮病毒蛋白种子的共同机制为整合和加速对这一日益增长的毁灭性退行性疾病类别的研究提供了未开发的机会。
https://blog.sciencenet.cn/blog-41174-1452307.html
上一篇:氢气对人类脂肪组织的直接效应研究
下一篇:人工智能能感到痛苦吗?