博文
多光子催化剂靶向水解氢气疗法
||
氢气具有疾病治疗潜力,但是氢溶解度比较小,外源性补充存在难度。不过,身体组织内含有丰富的还原剂,这些还原剂能提供丰富的氢原子或电子,这能成为氢气生产的原料。这是本研究的思路出发点。需要强调的是,氢气的医学优点是生物安全性,利用材料实现氢气的供应则是打破了这一优势,新材料应用于人体都需要进行生物安全性考察,这会导致逻辑上的矛盾。
近日发表在Adv Sci的研究论文作者单位来自安徽大学。
Lu X, Yu X, Li B, Sun X, Cheng L, Kai Y, Zhou H, Tian Y, Li D. Harnessing Metal-Organic Frameworks for NIR-II Light-Driven Multiphoton Photocatalytic Water Splitting in Hydrogen Therapy. Adv Sci (Weinh). 2024 Aug 9:e2405643.
在构建近红外(NIR)光激活产氢材料方面,实现对深层肿瘤组织中氢气分子的可控产生和高浓度释放,以及增强氢疗效果,具有重要的科学意义。为了解决窄带隙光催化材料低效率氧化还原反应的关键科技难题,本研究提出了一种创新的方法,用于可控制备多光子光催化材料,以克服传统近红外光催化剂受“窄带隙”限制的问题。在此,我们利用后合成配位修饰策略,将氢化活性位点CoII引入到多光子响应性MOF(ZrTc)中,开发了一种NIR响应型多光子光催化剂ZrTc-Co。结果显示,通过引入CoII位点,可以有效抑制电子-空穴复合,从而提高了析氢反应的效率。此外,CoII的整合可以有效地促进电荷转移并提高静态超极化率,使ZrTc-Co具有出色的多光子吸收能力。而且,透明质酸的修饰为ZrTc-Co提供了癌细胞特异性靶向特性,为肿瘤特异性消除奠定了基础。总的来说,所提出的发现呈现了一种构建NIR-II光介导的氢治疗剂以消除深层肿瘤的策略。
1 引言
氢气(H2),作为一种清洁/安全的治疗分子,因其卓越的抗氧化和抗癌性能而受到广泛关注。然而,H2的低溶解度和易扩散性给当前常规的给氢方法带来了挑战,例如吸入H2或饮用富氢水。这些方法效率低下,难以在病灶部位实现持续和可控的H2产生,从而限制了H2在肿瘤治疗中的有效性。为解决这一问题,一种方法是采用光催化材料,利用肿瘤微环境中的还原性化学物质,如谷胱甘肽和烟酰胺腺嘌呤二核苷酸磷酸(NAD(P)H),作为人工光催化剂的牺牲剂。这种创新方法通过光催化水解实现了在肿瘤组织内连续和可控地产生H2。因此,它为癌症治疗中H2的可控释放和治疗提供了一条有希望的新途径。
事实上,与可见光相比,近红外(NIR)光具有更优的组织穿透能力。通过使用NIR光响应型光催化剂驱动水解产生氢气,为在深层肿瘤部位控制释放H2提供了一个可行方案。这一发展对于癌症治疗领域H2疗法具有重要意义。然而,由于窄带隙光催化材料的低氧化还原电位和高电荷载流子复合率,实现高效的氧化还原反应是一个挑战,这在开发用于NIR光驱动产氢的材料时构成了一个重大难题。为了克服NIR光低能量激发状态阻碍有效氧化还原反应的挑战,研究人员提出了一种策略,即利用能够吸收两个或更多NIR光子以达到更高能量激发态的光催化剂。这种方法能够实现有效的NIR光催化,解决了NIR光能量低的限制,促进了有效的氧化还原反应。多光子吸收材料提供了一种机会,可以克服传统“窄带隙”NIR光催化剂的限制。这些材料允许对NIR光进行敏化,并为开发新型高效的NIR光催化产氢材料提供了平台。此外,它们的非线性光学性质使得可以通过多光子激发精确激活分布在肿瘤组织三维空间内的光催化剂。这一能力为H2疗法中的高效NIR光催化提供了有力支持,允许有针对性的激活和提高性能。因此,制备具有出色多光子吸收效果的NIR光催化材料非常重要。这种方法涉及扩展和增强光催化剂的NIR光吸收能力,同时实现高电子-空穴分离效率和利用。这一进展对于在深层肿瘤组织中有效生成和高浓度积累H2至关重要,从而增强了H2治疗的效果。
基于肿瘤治疗[9]、光催化[10]以及使用金属有机框架(MOFs)构建多光子材料[11]等领域的研究成果,可以有力地论证,基于MOFs制造多光子响应型近红外(NIR)光催化剂用于氢气(H2)治疗在理论上是可行的并且具有独特的优势。在此,我们以前关于多光子响应金属有机框架(ZrTc)的工作为基础[12],通过后合成修饰引入了CoII光催化活性位点(称为ZrTc-Co),以制备用于产氢的多光子响应型NIR光催化材料。考虑到CoII的配位环境和相关文献报道[13],我们使用Gaussian 16构建了优化模型(图1A)。基于此模型,我们计算了多光子性能和催化性能的相关参数。如密度泛函理论(DFT)计算所揭示,ZrTc-Co显示出比ZrTc更大的静态第一超极化率(β)和静态第二超极化率(γ),表明其增强了多光子吸收活性(图1B)。此外,我们利用静电势和电荷密度分布计算评估了光生电子和空穴分离的效率,这对于光催化至关重要[14]。如图1C所示,ZrTc-Co中CoII位点周围的平均电势(-28.08 kcal mol^-1)比ZrTc(0.37 kcal mol^-1)更负,表明电荷在Co原子附近积累,并且光生电荷载体有效分离。这进一步得到了ZrTc-Co中电子和空穴分离模拟的支持,表明改善了电荷分离并为析氢反应(HER)创造了有利条件(图1D)。此外,HER过程中间态的吉布斯自由能(ΔGH)反映了H的吸附/解吸能力,这是HER性能的关键指标。图1E展示了理论上构建的H原子吸附构型,表明引入CoII活性位点导致更接近热中性状态(|∆GH*|→0),促进了HER过程的动力学。综上所述,这些计算结果强调了在ZrTc中引入活性CoII位点提高了多光子吸收系数和电子-空穴分离,使ZrTc-Co成为多光子光催化析氢的有希望的候选者。
2 结果与讨论
受到鼓舞人心的计算结果和进一步生物医学应用潜力的激励,我们开始了纳米级ZrTc-Co的合成。首先,按照我们之前的方法稍作修改制备了纳米级ZrTc[12]。随后,通过将ZrTc与CoCl2•6H2O配位获得了ZrTc-Co,如图2A所示。扫描电子显微镜(SEM)和透射电子显微镜(TEM)分析揭示了ZrTc-Co的八面体形态,而元素映射显示了钴的均匀分布(图2B,C)。此外,X射线光电子能谱(XPS)结果(图2D;支持信息图S1)确认了Co与ZrTc的成功配位,钴呈现+2氧化态。与ZrTc相比,ZrTc-Co中N 1s和S 2p的结合能红移表明Co与N/S原子之间的配位(支持信息图S2)。此外,傅里叶变换红外(FT-IR)光谱提供了ZrTc-Co成功形成的额外证据。值得注意的是,355、548和932 cm^-1处的特征振动峰分别对应于Co─N、Co─O和Co─S键的伸缩模式(图2E,支持信息图S3)。[16]结合上述结果和ZrTc-Co的质谱结果(支持信息图S4),确认了CoII的配位方式,如图2A所示,这与DFT计算的结果一致。
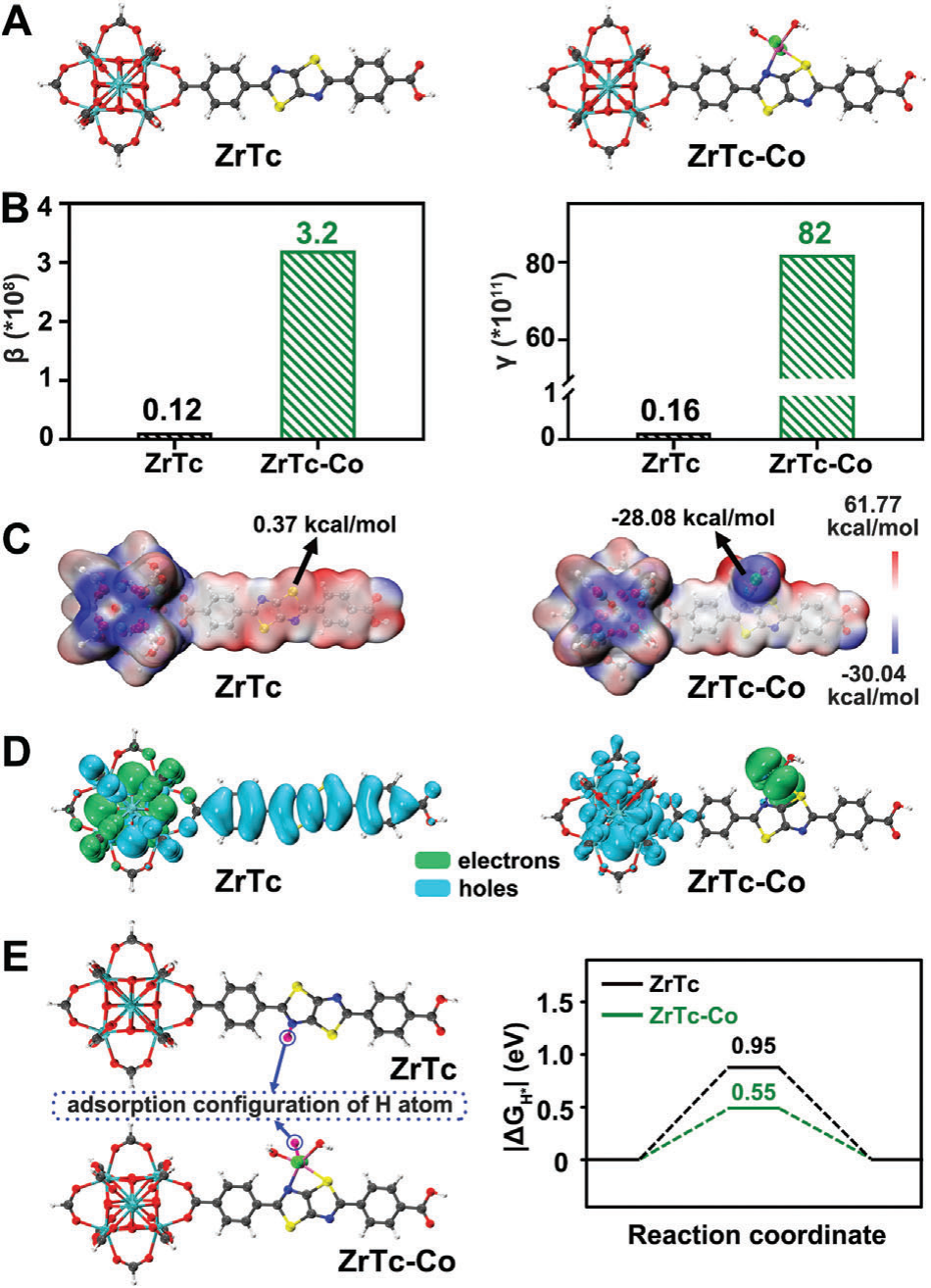
图1 A) ZrTc和ZrTc-Co的计算模型。B) ZrTc和ZrTc-Co之间的静态第一超极化率(β)和第二超极化率(γ)的比较。C) ZrTc和ZrTc-Co的静电势表面图。D) ZrTc和ZrTc-Co的电子-空穴分布图。橄榄色:电子;青色:空穴。E) H原子的吸附配置和计算的Gibbs自由能曲线(∆GH*)的ZrTc和ZrTc-Co。
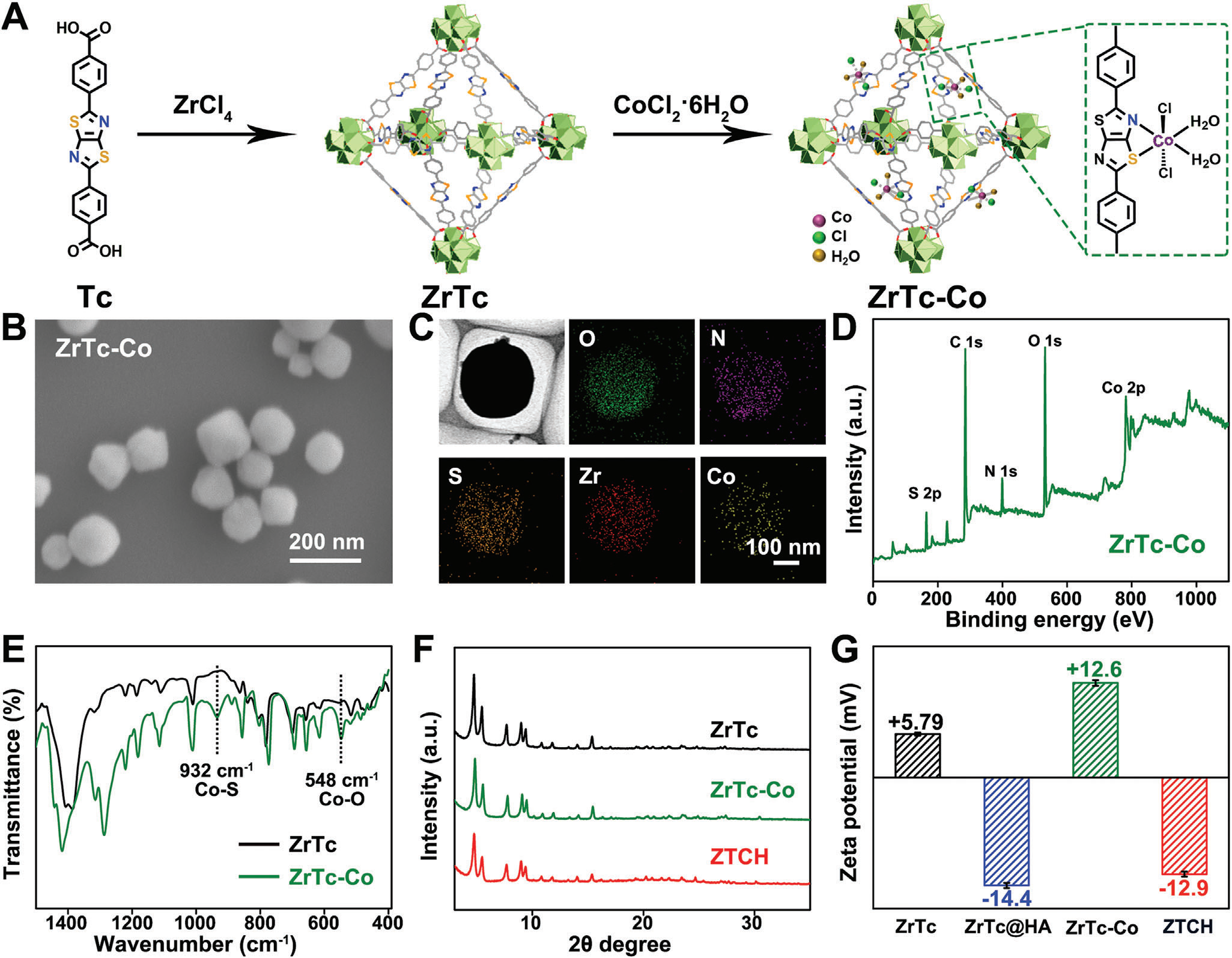
图2 A) ZrTc-Co的合成路线。B) ZrTc-Co的SEM图像(比例尺:200 nm)。C) ZrTc-Co的TEM图像(带状支持膜)及其对应的元素映射图像(比例尺:100 nm)。D) ZrTc-Co的XPS光谱。E) ZrTc和ZrTc-Co的FT-IR光谱。F) ZrTc、ZrTc-Co和ZTCH的PXRD图谱,以及ZrTc和ZrTc-Co的Lebail精修显示在图S6(支持信息)中。G) ZrTc、ZrTc@HA、ZrTc-Co和ZTCH在去离子水中的Zeta电位(n = 5次独立实验)。
随后,我们使用透明质酸(HA)来包裹ZrTc-Co,从而增强了胶体稳定性和对癌细胞的特异性靶向能力(称为ZTCH,见支持信息图S5)。PXRD模式和SEM图像显示反应后结构保持稳定(见图2F,支持信息图S6和S7)。此外,引入CoII后,ZrTc-Co的zeta电位为+12.6 mV,经过HA涂层后变为负值(−12.9 mV)(见图2G),表明HA涂层成功。此外,在pH 7.4的磷酸盐缓冲盐水(PBS)溶液中,动态光散射测量ZTCH在7天内的平均直径为210±10 nm,多分散性指数低至0.06(见支持信息图S8),显示出良好的稳定性,变化可以忽略不计。
显然,ZTCH和参考样品ZrTc@HA在可见光区域都表现出明显的吸收带(见图3A)。然后,我们对相关样品进行了光电化学测试。如图3B所示,与原始ZrTc@HA以及ZrTc与CoCl2•6H2O的混合物相比,ZTCH的光电流显著增强。这种增强表明,引入CoII有助于有效分离光生电子-空穴对。这一发现进一步得到了电化学阻抗谱(EIS)结果的支持,如图3C所示,ZTCH显示出明显更小的半径,表明电荷传递阻力更低。此外,ZTCH的光致发光(PL)强度明显降低,为电子-空穴复合抑制提供了进一步证据(见图3D)。此外,通过拟合时间分辨PL光谱,确定ZrTc@HA和ZTCH的PL寿命分别为880 ps和3.83 ps(见图3E)。更短的PL寿命意味着光生电子的传输更快,强烈抑制了光生载流子的复合,表明光催化活性更高。此外,基于漫反射紫外-可见(DR UV-vis)光谱计算了ZrTc@HA和ZTCH的光学带隙,如图3F所示。与ZrTc@HA相比,ZTCH的光学间隙从2.44降至2.34 eV。另外,通过Mott-Schottky测量确定了ZrTc@HA和ZTCH的导带位置分别为-0.4和-0.58 V(相对于标准氢电极,pH = 7)(见支持信息图S9)。相应的能级图呈现在图3F中。ZTCH的最低未占分子轨道(LUMO)位置明显高于ZrTc@HA,表明有更强的热力学驱动力和电子还原能力,这促进了光催化氢气演化能力。而且,ZTCH的LUMO水平比H+/H2氧化还原电位(0.00 V vs NHE,pH = 7)更负,表明具有光催化H2演化的能力。
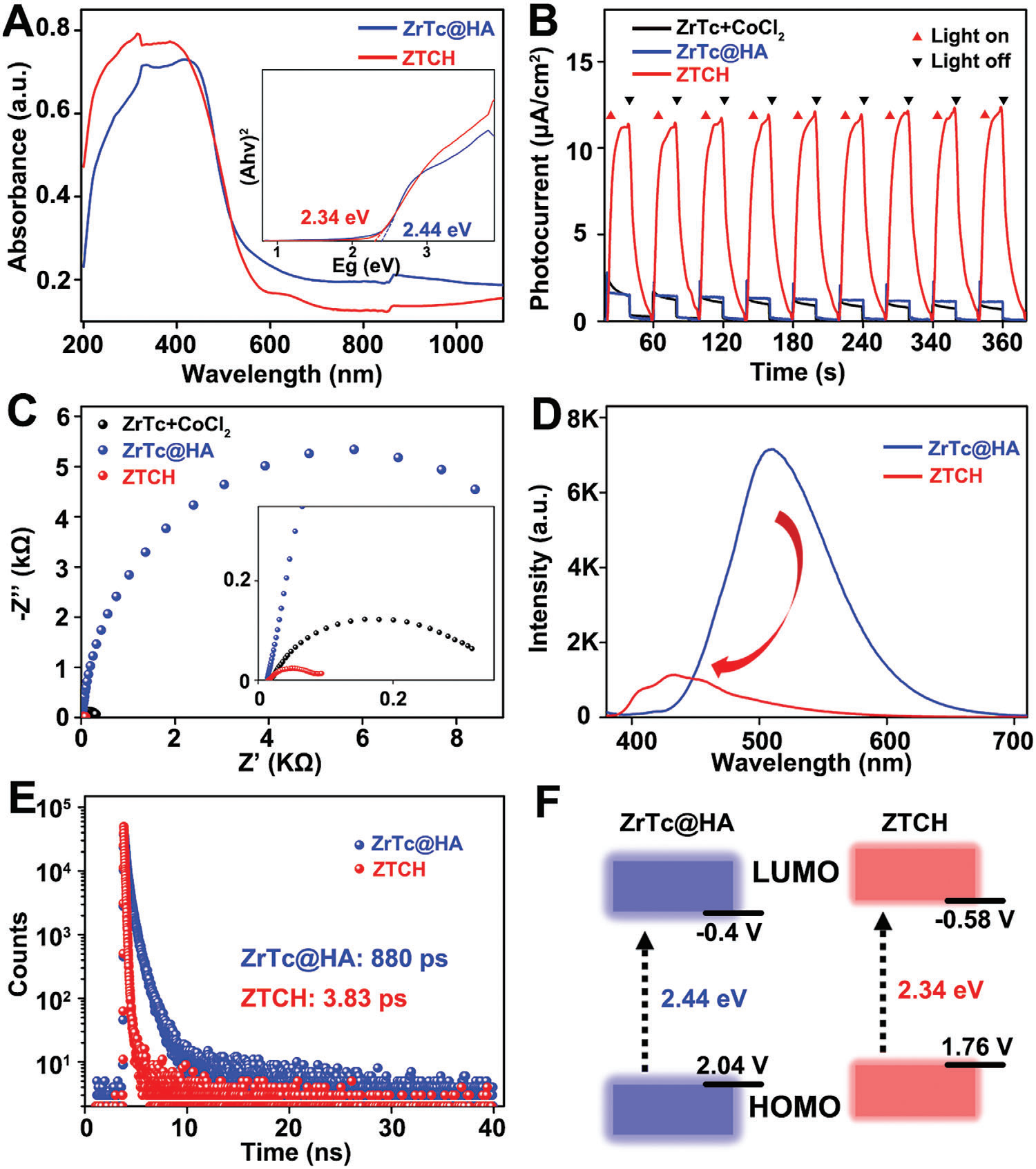
图3A) ZrTc@HA和ZTCH的漫反射紫外-可见光谱。插图:ZrTc@HA和ZTCH的Tauc图。B) 在可见光照射下,ZrTc@HA和ZTCH的光电流响应。C) ZrTc@HA和ZTCH的电化学阻抗谱Nyquist图。D) ZrTc@HA和ZTCH的室温PL发射光谱(激发波长:370 nm)。E) ZrTc@HA和ZTCH的PL衰减轨迹。F) ZrTc@HA和ZTCH的能级图。
受到这些令人鼓舞的发现,我们研究了ZTCH、ZrTc@HA以及ZrTc与CoCl2•6H2O的物理混合物在可见光照射下水分解制氢的性能。此外,我们还进行了优化过程,以确定ZTCH中CoII的最佳含量,以实现高效的H2生成(图S10和S11,支持信息,详细讨论见支持信息第S2.4节)。为了模拟肿瘤微环境,使用在肿瘤中过度表达的还原性物质NADH作为空穴牺牲剂。经过60分钟的光照射后,含钴量为3.44%的ZTCH显示出最高的H2产生率,达到1477 µmol g−1,超过了ZrTc@HA和ZrTc与CoCl2•6H2O物理混合物的性能(图4A)。此外,通过紫外-可见吸收光谱验证了催化过程中NADH的消耗。如图S12(支持信息)所示,NADH在340 nm处的特征峰逐渐减弱,而随着照射时间延长,NAD+在260 nm处的吸收峰强度增加,表明NADH被消耗。[18]此外,开关实验证明了ZTCH对光响应产氢的高可控性和稳定性(图4B)。此外,循环实验表明,连续三次催化运行中产氢率没有显著降低,突出了ZTCH的出色稳定性(图4C)。催化过程后的SEM图像证实了ZTCH的结构完整性,而PXRD和XPS分析显示晶体相和氧化态变化可以忽略不计,进一步表明ZTCH的良好稳定性(图S13,支持信息)。这些结果清楚地证明了ZTCH在氢气生成方面的高效率,并确立了其作为优良光催化剂的地位。
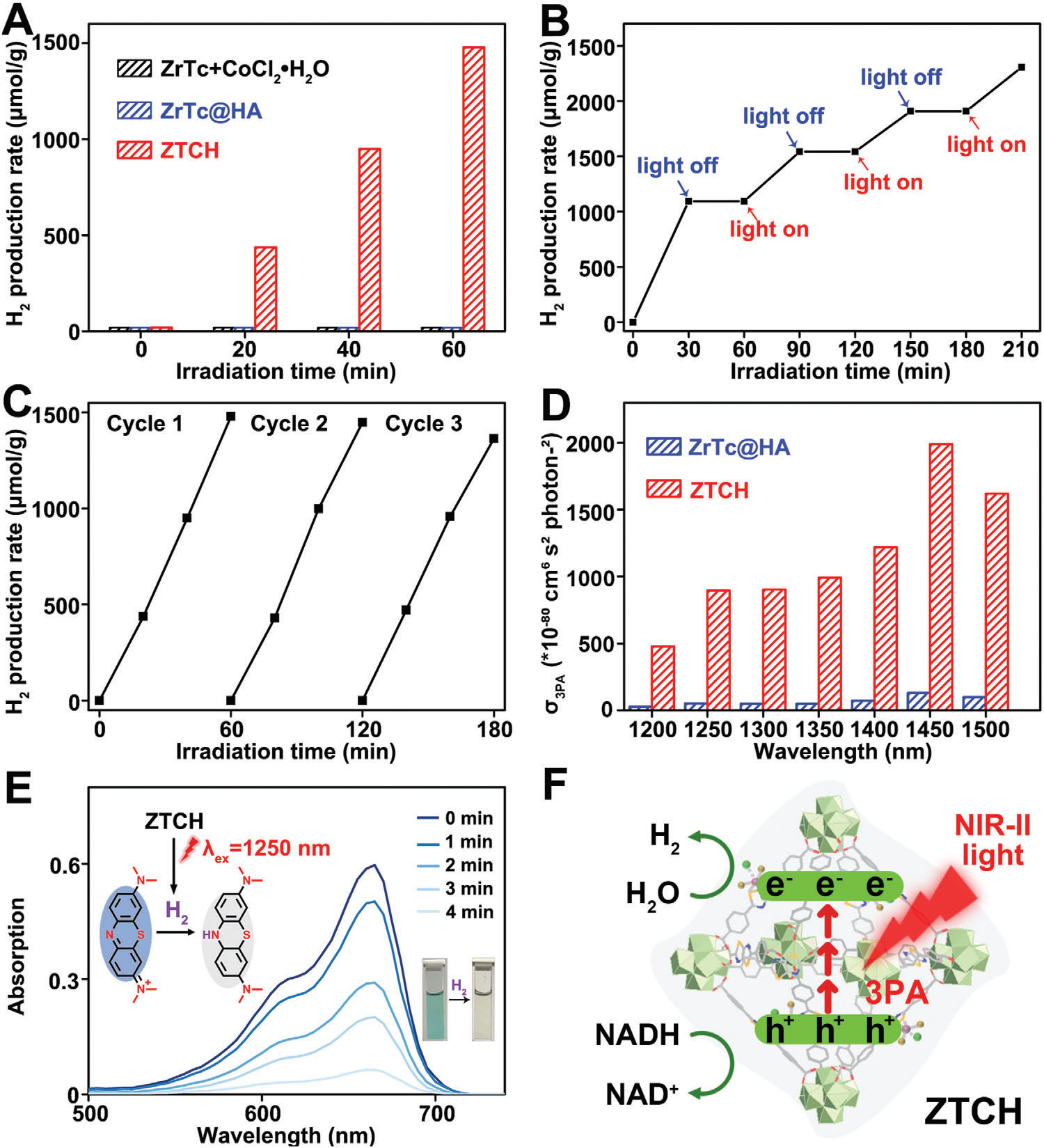
图4 A) ZrTc和CoCl2•6H2O的物理混合物、ZrTc@HA和ZTCH的H2产生率。B) ZTCH的关闭-开启实验。C) ZTCH的H2演化循环实验。H2生成实验的反应条件:10 mg催化剂,30 mL H2O,0.4 mm NADH,300 W氙灯使用λ > 400 nm滤光片。D) ZrTc@HA和ZTCH的三光子吸收截面(浓度:500 µg mL−1,λex: 1200–1500 nm,激光功率:1 W cm−2,溶剂:去离子水)。E) 在1250 nm激光照射下4分钟内MB的吸收光谱(激光功率:1 W cm−2)。F) ZTCH多光子光催化制氢的示意图。
为了进一步探索ZTCH在氢气治疗中的潜在应用,评估其在NIR光下的光催化水分解性能具有重要意义。基于我们之前关于ZrTc多光子激发荧光性能的研究,我们旨在研究ZTCH在NIR-II激光照射下(1200–1500 nm)的多光子活性,以评估其NIR-II诱导的氢气演化能力。如图S14和S15(支持信息)所示,ZrTc@HA和ZTCH都显示出显著的三光子激发荧光。而且,在1250 nm处,ZTCH的三光子吸收截面(8.95 × 10−78 cm6 s2 photon−2)高于ZrTc@HA(0.525 × 10−78 cm6 s2 photon−2),表明其具有优异的NIR-II光激发能力(图4D)。考虑到ZTCH在可见光激活下的出色H2演化能力和在NIR-II激光照射下的显著多光子吸收活性,我们进一步研究了其在1250 nm激光照射下使用甲基蓝(MB)作为H2探针以及合成的氢气探针(NDO-N3,图S16,支持信息)时的H2演化能力。[19]这项调查的反应条件详见支持信息。显然,来自NDO-N3探针的荧光发射强度在约580 nm处明显增加,表明H2还原了叠氮基团,并确认了ZTCH的有效光驱动H2生成。此外,MB可以被H2还原为无色的leuco-methylene blue。如图4E所示,MB在665 nm处的吸收在1250 nm激光照射下逐渐减少,表明产生了H2。通过应用Lambert‒Beer定律,计算得出在1250 nm激光照射下4分钟内产生的H2量为21.54 µm(图S18,支持信息)。这种在NIR-II光照射下高产H2的能力(支持信息第S2.5节,表S1,支持信息)为氢气治疗奠定了基础。[20]
在ZTCH出色的NIR-II光驱动多光子光催化产氢能力的基础上(图4F),我们进一步研究了其体外和体内的抗肿瘤性能。利用HA的修饰,我们首先探索了ZTCH的细胞摄取和靶向行为。如图S19(支持信息)所示,ZTCH对HepG2肿瘤细胞(人肝瘤细胞;CD44受体阳性细胞)展现出选择性靶向,而对Hek 293T细胞(人胚肾细胞;CD44阴性细胞)的摄取则很少。在HepG2细胞中显著观察到ZTCH的细胞内荧光,表明成功的细胞摄取和定位。这一发现得到了进一步的支持,通过Western blot检测显示与ZTCH孵育后HepG2细胞中CD44表达的上调(图S20,支持信息)。此外,还探索了ZTCH在HepG2细胞中的细胞摄取途径机制,结果显示该过程主要依赖于能量依赖性内吞作用和小窝蛋白介导的内吞作用(图S21,支持信息)。
为了确定氢气在肿瘤治疗中的作用,我们首先评估了ZTCH的光热性质。红外成像结果显示,在1250 nm激光照射下10分钟,ZTCH的温度变化可以忽略不计,因此在激活过程中排除了热效应(图S22,支持信息)。随后,使用MB分析了NIR-II光触发的ZTCH细胞内H2释放。如图5A所示,与MB共培养后的细胞呈现蓝色,并在照射后逐渐褪色,表明在NIR-II光照射下ZTCH产生了H2。此外,我们使用NDO-N3检测了在1250 nm激光照射下HepG2细胞中的H2生成(图S23,支持信息)。照射后,观察到荧光强度增加,证明了NIR-II光触发的ZTCH在细胞内释放了H2。通过测量665 nm处MB的吸光度,使用微板读数器量化了产生的氢气量。根据标准曲线,计算得出在15分钟内氢气浓度为19.5 µm(图S24和S25,支持信息)。此外,通过在340 nm处吸光度的显著降低,确定了肿瘤细胞中NADH的消耗(图S26,支持信息)。总的来说,上述结果展示了在NIR-II激光激活下ZTCH在Hep G2细胞内有效的光催化产氢过程。
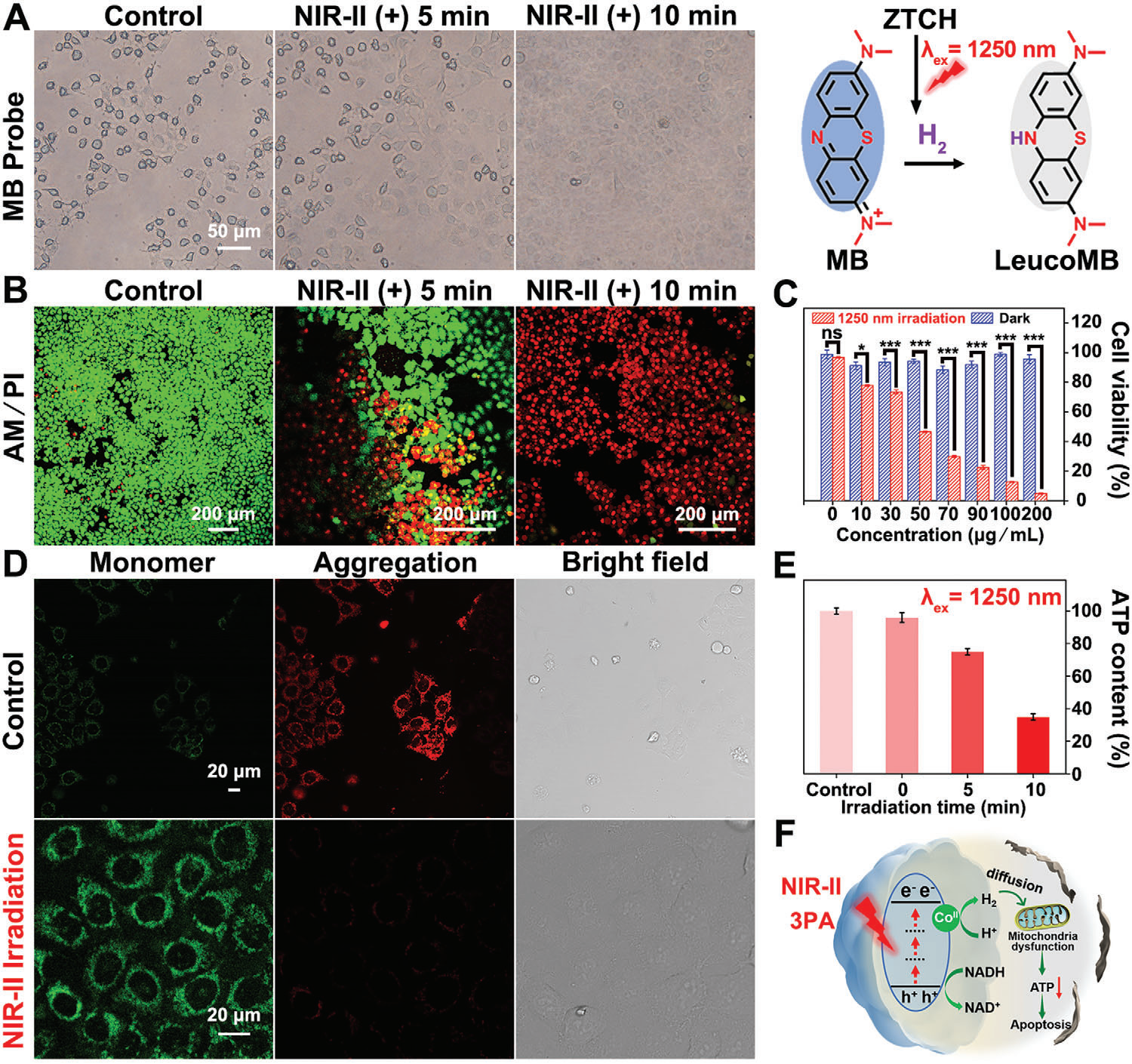
图5 A)在不同照射时间下对MB染色的Hep G2细胞中H2生成的定性分析(λex = 1250 nm,激光功率:0.1 W cm−2)。B) 用ZTCH(50 µg mL−1)处理的HepG2细胞在不同照射时间下的CLSM图像,用calcein AM/PI染色(λex = 1250 nm,激光功率:0.1 W cm−2)。C) 用不同浓度(0、10、30、50、70、90、100、200 µg mL−1)的ZTCH孵育的HepG2细胞在有无1250 nm激光照射下的存活率(激光功率:0.1 W cm−2)。数据以平均值±标准差表示(n = 5)。采用非配对t检验进行分析(ns, 不显著,*p < 0.05, **p < 0.01, ***p < 0.001)。D) JC-1染色的HepG2细胞在用1250 nm激光照射前后的CLSM图像(激光功率:0.1 W cm−2)。E) 在激光照射下与ZTCH孵育的HepG2细胞内ATP水平随时间的变化(λex = 1250 nm,激光功率:0.1 W cm−2)。F) 基于ZTCH在NIR-II激光下氢气治疗的提出机制(激光功率:0.1 W cm−2)。
此外,通过使用钙黄绿素乙酰甲酯(calcein AM,绿色荧光,活细胞指示剂)和碘化丙啶(PI,红色荧光,死细胞指示剂)评估了ZTCH在NIR-II光照射下诱导的细胞凋亡。如图5B所示,随着激光照射时间的延长,观察到来自PI的明显红色荧光信号增强,表明ZTCH具有显著的治疗效果。而且,如图5C所示,即使在高达200 µg mL−1的浓度下,ZTCH在暗条件下对细胞存活率的影响相对较小(通过甲基噻唑基四唑氯化铵法评估),表明其具有高细胞相容性。然而,在1250 nm激光照射下,观察到细胞存活率显著下降。因此,总结来说,ZTCH可以在NIR-II光照射下有效消耗癌细胞内的NADH,导致氢气产生并触发细胞凋亡。先前的研究已广泛证明,氢气可以特异性靶向线粒体,并通过抑制三磷酸腺苷(ATP)合成和损害线粒体功能来诱导细胞凋亡。线粒体膜电位(MMP)是线粒体健康的关键指标,凋亡过程通常伴随着MMP的降低,这可以通过四氯四乙基苯并咪唑羰花青碘(JC-1)染料的颜色变化来检测。如图5D所示,照射组显示出明显的绿色荧光,表明MMP低和单体形成,暗示产生的H2有效地破坏了MMP。此外,激光照射后ATP含量显著减少(图5E)。这些引人注目的结果共同证明了ZTCH可以作为一种高效的NIR-II响应型光催化剂,通过H2介导的线粒体损伤诱导癌细胞死亡(图5F)。
一般来说,NIR光具有更深的穿透能力,特别适用于深部肿瘤的治疗。为了评估ZTCH在1250 nm NIR光下的穿透深度,获取了小鼠心肌组织切片。如图S27(支持信息)所示,在1250 nm照射下的穿透深度至少达到140 µm。此外,使用Hep G2 3D多细胞球体(MCSs)验证了ZTCH治疗深部肿瘤的效果。MCSs用ZTCH处理并用calcein AM/PI染色(图S28,支持信息)。在405 nm处理的MCSs中,仅在MCSs的边缘观察到来自PI的红色荧光。相反,在1250 nm激发下,PI的红色荧光分布在整个肿瘤部分,甚至在肿瘤中心也清晰可见。这些发现表明,ZTCH是一种有效的NIR光诱导的氢气疗法,用于治疗深部肿瘤。因此,我们继续使用H22癌症小鼠模型评估ZTCH的体内癌症靶向和治疗行为(图6A)。基于其低溶血率(3.6%),确认了ZTCH的出色生物安全性,通常认为这对静脉注射是安全的(图S29,支持信息)。此外,通过荧光成像评估了ZTCH的肿瘤靶向行为(图S30,支持信息),清楚地显示了静脉注射后24小时ZTCH在肿瘤部位的积累。此外,药代动力学分析显示了相对长的血液循环半衰期为2.26小时(图S31,支持信息)。
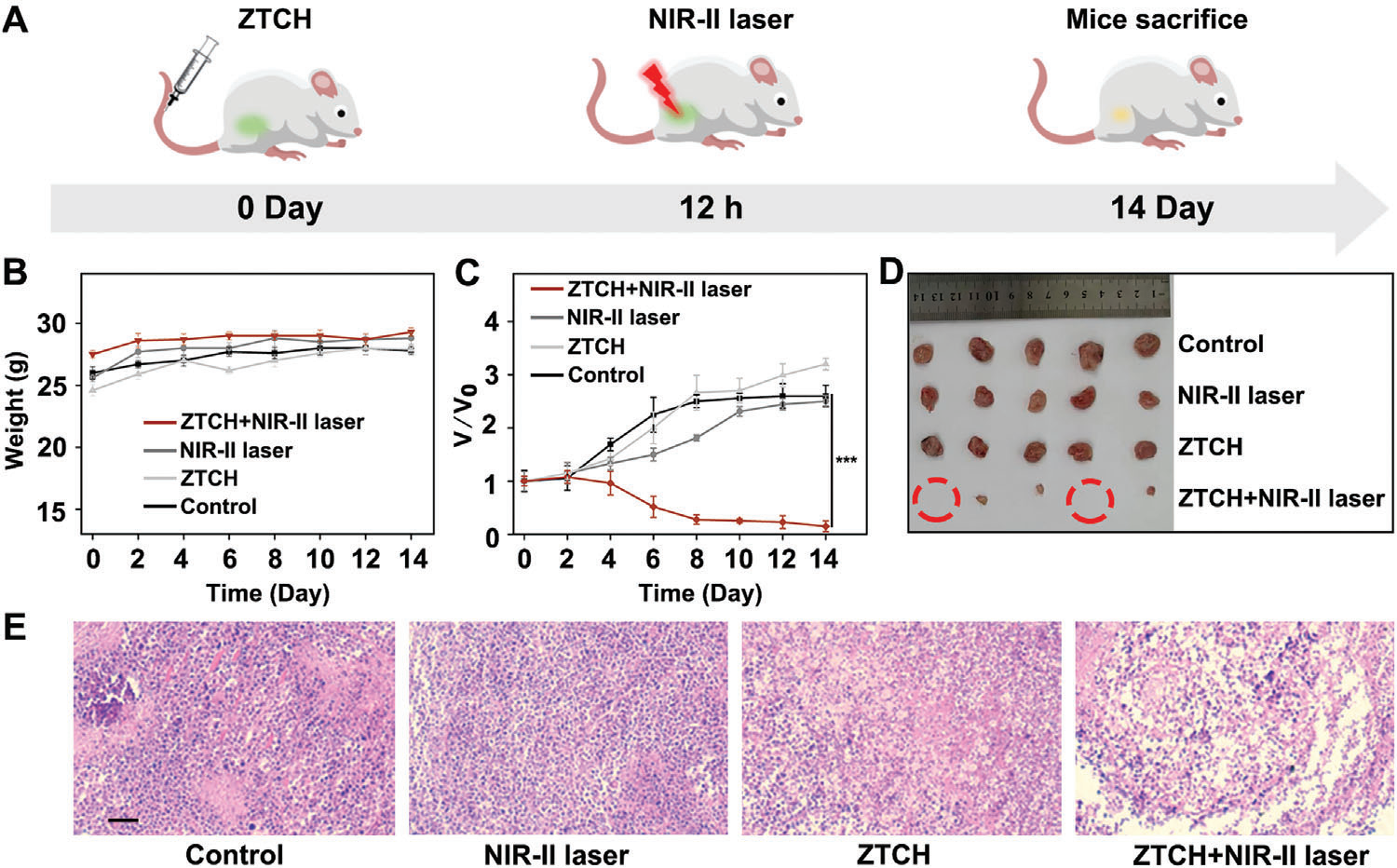
图6 A) 说明了H22皮下肿瘤荷瘤雌性ICR小鼠模型的发展和治疗过程的示意图。B) 控制组、NIR-II激光、ZTCH和ZTCH加NIR-II激光组ICR小鼠的体重(n = 5次独立实验)。C) 控制组、NIR-II激光、ZTCH和ZTCH加NIR-II激光组的肿瘤体积(n = 5次独立实验)。D) 不同治疗组肿瘤的照片。E) 不同治疗组肿瘤切片的H&E染色(比例尺:500 µm)。
考虑到这些特殊性质,我们进一步评估了ZTCH在1250 nm照射下的抗癌效果(图6A)。将荷瘤小鼠分为对照组、NIR-II激光照射组、ZTCH组和ZTCH加NIR-II激光照射组。如图6B、图S32和S33(支持信息)所示,所有治疗组在治疗后体重没有变化,主要器官未见明显损伤,血液学参数也没有显著变化。此外,实验组在治疗后明显表现出显著的肿瘤抑制效果(95%),证明了使用ZTCH进行光催化氢气疗法的高效性(图6C、D,图S34,支持信息,表S2,支持信息)。H&E染色的肿瘤切片显示,与激光照射相结合的ZTCH诱导了明显的肿瘤细胞凋亡(图6E)。然而,在相同条件下,ZrTc@HA表现出较低的体外和体内抗癌效率(图S35–S37,支持信息,表S3,支持信息)。因此,ZTCH在NIR-II光驱动下的显著多光子光催化产氢能力使其成为肿瘤治疗应用的有希望的候选者。
3 结论
总之,一种多光子响应型金属有机框架材料ZTCH,具有相当的多光子吸收截面和电子-空穴分离效率,用于NIR-II光驱动的多光子光催化H2疗法。通过利用过量的细胞内NADH作为牺牲剂,ZTCH展现出卓越的稳定性,能够在水溶液和细胞内环境中产生H2。此外,引入透明质酸修饰增强了ZTCH的胶体稳定性,并赋予了它对癌细胞的特异性靶向能力,促进了在深部肿瘤部位精确的NIR-II光触发的H2生成,从而实现有效的肿瘤治疗。这项工作为可控制备多光子光催化材料提供了创新方法,以克服传统近红外光催化剂因“窄带隙”限制而面临的挑战,为在深部肿瘤实现H2的可控生成和高浓度释放以及提高H2治疗效果提供了有希望的途径。
https://blog.sciencenet.cn/blog-41174-1445849.html
上一篇:大脑创伤的大爆炸理论《科学》专家观点
下一篇:氢水对新冠患者预后没有作用【阴性】