博文
氢气抗氧化作用的探索性研究(1994年)
||
氢气抗氧化作用的探索性研究(1994年)
这个研究是要回答一个问题,在高压氢气下,这在当时已经进入尾声,也成熟起来的氢氧潜水技术上是人类需要暴露的一种环境。氢气是否会被人类细胞分解,这是非常重要的问题,因为一旦能分解,将意味着氢气在组织中的分压可以被快速减少,这对于潜水技术来说,会增加非常大不确定性。不过对于今天的氢气医学来说,这一问题也是非常重要的。因为氢气能否可以被代谢分解,意味着我们理解氢气的生物医学效应的角度不同,如果完全不能被分解,则这种作用只能和其他惰性气体如氮气和氙气的方式类似,如果能被分解,则氢气可以变成氢原子,发挥更多种更强大的生物学效应。当然效应强大也同时意味着更高复杂度,更高复杂度也意味着更高风险度。
说是探索性研究,是因为这一研究的特点是对氢气高压下哺乳动物组织是否能分解氢气。这一作用,可以说是证明氢气具有生理作用的最重要证据,可惜的是,当时的研究是失败的。那么按照逻辑分析,这一研究应该能证伪氢气的医学效应,因此说这是极其重要的文献,但现在的氢气医学似乎把这篇文章完全屏蔽(至今引用次数才33次),是不敢说,还是不能说。我们首先要把这篇文章找来认真全面阅读,看到底是否能证伪氢气的生物学效应。
读后记:我认为这个研究不能证伪氢气能代谢。值得注意的是,这个实验是对体外组织进行的,标记的氚虽然检测非常灵敏,但采用的标记比例并不太高。结果呈现阴性也理所当然,但不能完全否定氢气能被动物细胞代谢,相对于细菌,动物细胞有可能代谢氢气的速度非常低,且细胞量比较少时间比较短的情况下,这种方法的灵敏度检测不到。重复研究可以采用无菌小鼠,然动物长时间处于标记环境,或使用氘进行高比例标记。
摘要
哺乳动物组织,包括豚鼠、大鼠或猪的心脏、肺、肝、肾、脾和骨骼肌,被置于氚(T2)和高压氢气环境中。通过测量氚标记的掺入来测试哺乳动物组织在深潜者呼吸氢气时所经历的条件下氧化H₂ 的潜在能力。组织被无菌移除,并被切碎、匀浆或准备成活细胞培养物。将这些组织放入一个腔室中,加入8毫居里T2、1兆帕氦气以及1或5兆帕的H₂ 。一个小时后,腔室被减压。组织在涡旋混合器中短暂旋转以帮助消除气相中的T2。样品通过闪烁计数分析液相或组织中的氚掺入。生理盐水和蒸馏水被用作阴性对照。浸在水中的钯(Pd)珠和能代谢H₂ 的细菌Alcaligenes eutrophus的培养物被用作阳性对照。这些组织掺入了大约10纳居里T2每毫升,这意味着H₂ 的掺入量为每克组织每分钟10-50纳摩尔。然而,这种掺入量与水对照组中发现的并无差异,被归因于放射性同位素效应。Pd和细菌样本掺入的T2比哺乳动物组织多1000倍以上。我们得出结论,哺乳动物组织在高压条件下没有氧化H₂ ,检测限为每克组织每分钟100纳摩尔。
目前,氢气正被评估为深潜呼吸气体的一个主要成分。这就引出了一个问题:哺乳动物组织是否有能力在高氢压力和浓度的条件下氧化H₂。长期以来,人们一直认为在正常的大气条件下,氢气在哺乳动物体内是生物惰性的。当塞金(Armand Séguin)和拉瓦锡将一只豚鼠放在充满氢气氧气混合物的钟罩下时,他们发现“氢气没有减少,并且以大约相同的状态离开肺部,就像它进入时一样。”使用氢放射性同位素的更近期实验也没有发现在1个大气压下哺乳动物组织与H₂反应的证据。(重要文献Séguin A,Lavoisier A.Premier mémoire sur la respiration des animaux.Mém Acad Sci(Paris),1789:566-584.)
气态氢是一个极其稳定的分子,在大气温度和压力下不会自发地解离成氢离子。然而,许多细菌具有催化氢分子分解反应的酶系统,作为主要的代谢途径的一部分。一些藻类、鞭毛原生动物和植物中也报道了氢代谢。在这些生物体中,生化反应的方向是可逆的,根据H₂的浓度,要么合成要么分解H₂。氢气已经在人类和其他动物种类的潜水实验中使用。在超过2 MPa H₂的压力下,已经观察到麻醉甚至精神症状(psychotic effects)。有人推测,高压氢可能会产生生物学效应,如清除羟基自由基,干扰细胞色素氧化酶或使生物膜中的不饱和脂质水合。因此,测试在高压条件下H₂的氧化至关重要,以确定哺乳动物组织是否具有只在高压条件下才表现出来的氧化H₂的潜在能力。
在本研究中,来自豚鼠、大鼠和猪的无菌组织匀浆、切碎的组织和活组织培养物被暴露于稀释在1和5 MPa H₂中的氚(T₂)。减压后,样本中的H₂和T₂气体被冲洗掉。然后分析组织和它们浸泡在其中的水对氚标记的掺入,作为组织氧化H₂能力的证明。
材料与方法
组织制备
将豚鼠和大鼠置于氟烷麻醉下。使用无菌技术,从一只动物身上移除两个器官,然后对该动物进行安乐死。本研究使用的器官包括肾、肝、脾、心、肺和来自股四头肌的骨骼肌。称量这些器官并在无菌磷酸盐缓冲盐水中匀浆,pH值为7.4,或者用无菌手术刀片切碎并浸入磷酸盐缓冲盐水中,浓度为0.05-0.1 g·ml⁻¹。这些制备在从动物身上移除后的1小时内使用。每个器官制备的样本都分别在巧克力和血琼脂上接种;在37℃下培养48小时,同时进行需氧和厌氧条件的检查,以确保维持了无菌状态。
根据Sakai等人的方案(13),通过用胶原酶灌注心脏来制备大鼠心肌细胞。这些心肌细胞在分离后1小时内使用,并以6-8×10^4 cells·ml^-1的浓度形成亚融合培养。
从美国典型培养物保藏中心(Rockville, MD)获得了嗜铬细胞瘤12细胞(PC12;从大鼠可移植肾上腺髓质肿瘤克隆出的细胞)的冷冻库存。细胞的单层培养被繁殖并维持在标准生长培养基(14)上,并以1.3-1.5×10^6 cells·ml^-1的浓度作为亚融合培养使用。
毛细血管内皮细胞是从猪脑皮层中分离出来的。这些细胞在标准生长培养基(15)上繁殖并维持,并以10^6 cells·ml^-1的浓度作为亚融合培养使用。
组织样本和培养物(每个3毫升)被放置在已准备好的无菌培养皿中,培养皿的边缘有小缺口以确保在盖上盖子并堆放时气体能进入培养皿。在每次实验中,一叠六个含有组织的盘子中间都放了一个装无菌盐水的盘子。
对照实验
为了确定我们方法的敏感性,我们进行了两个阳性对照实验,一个使用有机物质,另一个使用无机物质,其中T₂的氧化是肯定的。
Alcaligenes eutrophus是一种常见于土壤中的革兰氏阴性细菌,已知可以代谢H₂ (16)。A.eutrophus的培养以异养方式生长(17)。培养物经离心以浓缩细菌。浓缩物在液氮中冻结,并在-70℃下储存。进行实验时,将冻结的细菌团解冻,悬浮在pH值为7.4的tris缓冲盐水中,并在0.5小时内使用。细菌细胞的浓度估计为4×10^9 cells·ml^-1。悬浮液被吸移到无菌培养皿中,并像哺乳动物组织一样处理。将细菌悬浮液的样本分别铺在巧克力和血琼脂上,并在37℃下培养48小时。大量的细菌生长验证了一些细菌在冻结和解冻后仍然存活。
钯(Pd)催化反应:H₂+1/2 O₂→ H₂O。每个样本中重0.1-0.7克的Pd珠被浸入3毫升无菌、经Millipore过滤的水中的无菌培养皿里。这些培养皿的处理方式与含有组织的相同。我们还进行了阴性对照实验,其中所有七个培养皿都装有无菌、经Millipore过滤的水。
氚暴露装置
该装置及其操作的详细描述见诸他处(18)。简而言之,T₂(杜邦-新英格兰核公司,波士顿,MA)以1 Ci(0.38毫升)装在玻璃安瓿中购买。安瓿放置在一个不锈钢压力室(内部体积330毫升)内,用氦气冲洗后再加压至2 MPa(图1)。压力室剧烈摇晃以打破安瓿并将T₂释放到载气He中。当为实验抽取小体积T₂时,气体从这个储藏室通过不锈钢管道流到一个黄铜室(内部体积250毫升),其中包含水分吸收剂(无水CaSO₄,Drierite, WA Hammond Drierite Co., Xenia, OH)。气体通过干燥剂渗透以去除污染的氚水蒸气。然后气体通到第二个黄铜压力室(内部体积250毫升)。每次实验的培养皿堆叠在这个室内,另外还有两个装有干燥剂的培养皿用于进一步去除氚水蒸气污染。当装载实验时,该室的自由气体体积是210毫升。
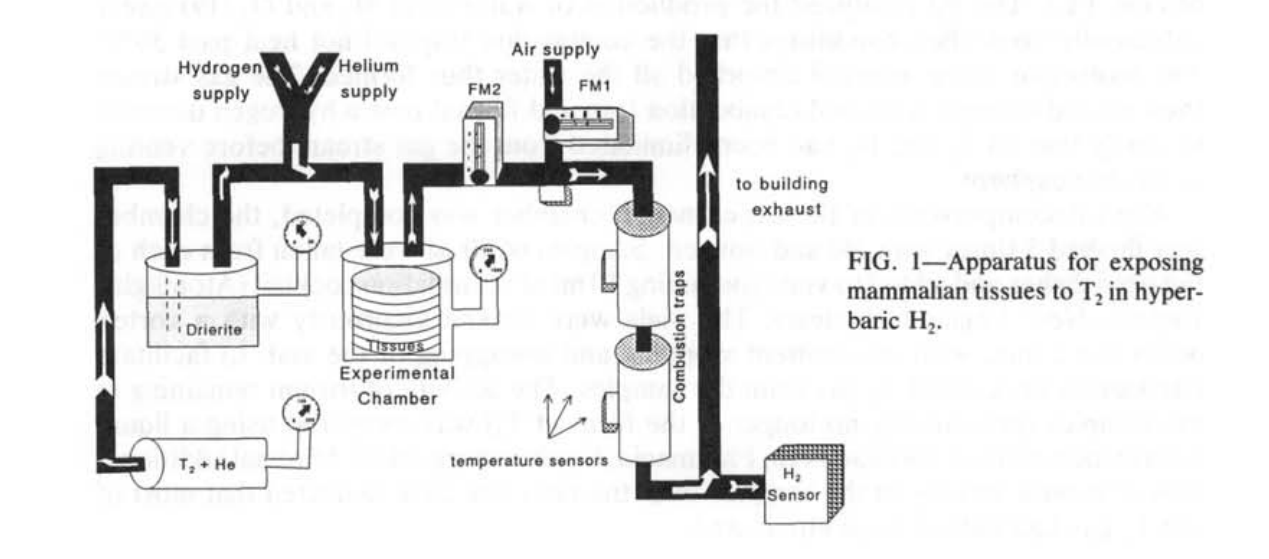
每次实验中释放的T₂活性(7.6-8.0 mCi)是通过T₂在He中的稀释和实验室内压力增加来计算的。为了释放8 mCi,需要的T₂体积是3.04 μl,这会在实验室内产生1.45 Pa的T₂分压。如此低的压力将极难精确测量。用He稀释T₂使得在产生26-27 kPa的室内压力的同时可以释放这小体积的T₂。这个压力可以用标准的0-200 kPa量表(Pacific Scientific, Newport Beach, CA)轻松测量。T₂-He混合物被允许与实验室内空气混合1-2分钟。然后以0.2 MPa·min⁻¹的速率向实验室加入He,直到表压达到1 MPa。He将最初密封在实验室内的空气中的O₂稀释到2%的浓度。在这种降低的O₂浓度下,接着可以用1或5 MPa的H₂(0.2 MPa·min⁻¹)继续加压实验室而不会有燃烧的危险。因此,实验室中的最终绝对压力是2.1或6.1 MPa。选择0.2MPa·min⁻¹的压缩速率是根据标准人类潜水室协议来的,确保了切碎的器官和培养物中的细胞的生存能力。在压缩过程中没有注意到室内有加热现象。
组织制备物在压力下保持了1小时。以0.04-0.05 MPa·min⁻¹的速率对室内进行减压,这是由安全要求决定的,用于排放H₂和T₂。实验室中的气体以1:100的体积比排入一股空气中,再次避免H₂和O₂形成可燃混合物。合并的气流通过一个装有Pd涂层分子筛材料的玻璃容器组成的燃烧陷阱(Science Glass Inc., Miami, FL)。Pd催化了H₂和O₂生成水的反应(19),在足够控制的条件下,燃烧陷阱的温度没有超过50℃。分子筛材料吸收了所有形成的水。然后气流通过第二个燃烧陷阱,并流经一个氢气探测器,以验证在排放到大气之前所有的T₂和H₂都已被消除。
当实验室减压完成后,用He冲洗3次并打开。从每个培养皿中取20 μl样品加入到含有10 ml闪烁液(Atomlight, DuPont-New England Nuclear)的小瓶中。用涡旋混合器剧烈摇晃小瓶2分钟,间歇性地停止并打开瓶盖,以促进样品中残留T₂气体的排除。使用液体闪烁计数器(Wallac 1410, Pharmacia, Gaithersburg, MD)测量样品中剩余氚的活性(假设不再以T₂的形式存在)。接下来几天内样品中氚活性的最小额外损失表明,大部分T₂气体确实已经被排除。
通过显微镜检查确认了潜水后细胞的存活能力。对于PC12和内皮细胞,我们使用了台盼蓝染色剂(在pH 7.4的磷酸盐缓冲盐水中占0.4%)作为细胞膜完整性的测试。对于心肌细胞,我们检查了细胞的自发收缩活动。潜水后的存活率与同期在实验室条件下相当;对于PC12和内皮细胞超过95%,对于心肌细胞为10-30%。
统计学分析
在每次实验中,六个装有组织或阳性对照的盘子和一个装有无菌盐水的盘子一起运行。对于细胞培养、钯和细菌悬浮液的实验,所有六个盘子的内容都相同;氚活性是根据这六个盘子的值的平均值和标准差计算得出的。对于组织匀浆和切碎组织的实验,三个盘子来自一个器官,另外三个来自另一个器官;每个器官的T₂活性是根据这三个盘子的值的平均值和标准差计算得出的。方差分析(ANOVA)用于测试每个实验中各盘子之间的显著差异,以及不同组织之间的差异。ANOVA还用于测试每个实验中组织与盐水对照盘之间的差异,以及组织与蒸馏水阴性对照盘之间的差异。对于每项分析,我们都包括了P值、F检验值和自由度(df)。
结果
哺乳动物组织匀浆、切碎的组织和细胞培养在暴露于1或5 MPa H₂的1小时期间,每毫升盐水中掺入了氚标记的纳居里活性(图2和3)。这种活性相当于每克组织或每10个细胞培养中的皮摩尔数量的T₂。在我们使用的T₂相对稀释度下(在1 MPa时为每69万个H₂中有1个T₂,在5 MPa时为每344万个H₂中有1个T₂),这意味着摄取量为10-50纳摩尔H₂*g⁻¹组织·min⁻¹(表1)。为了计算这些速率的时间周期,我们将从1 MPa H₂解压的0.5小时和从5 MPa H₂解压的2小时加到恒定压力下的1小时暴露时间,因为这些时间段显著增加了氢气暴露的长度。
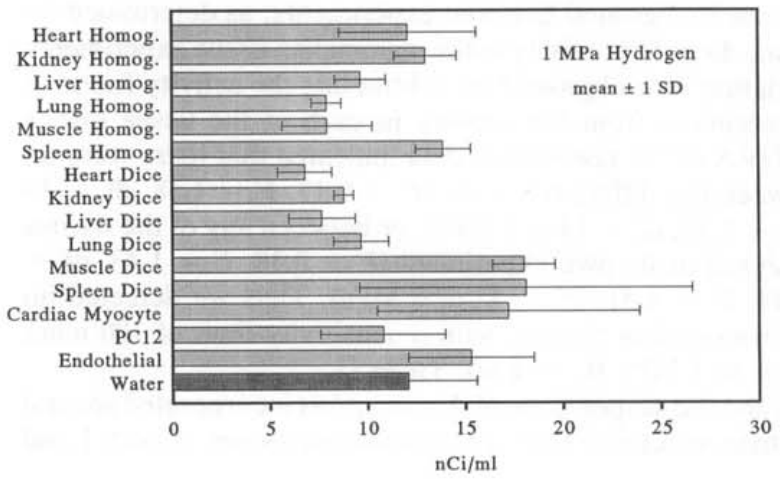
图2 — 在1小时暴露于8mCi T₂和1 MPa H₂后,组织匀浆样本中的总氚活性(来自一个器官的三个样本的平均值±1个标准差),切碎组织的样本(来自一个器官的三个样本的平均值±1个标准差),或活细胞培养(来自一个培养的六个样本的平均值±1个标准差)。图中还包括了在相同条件下暴露于T₂和H₂的无菌蒸馏水中的总氚活性(七个样本的平均值±1个标准差)。
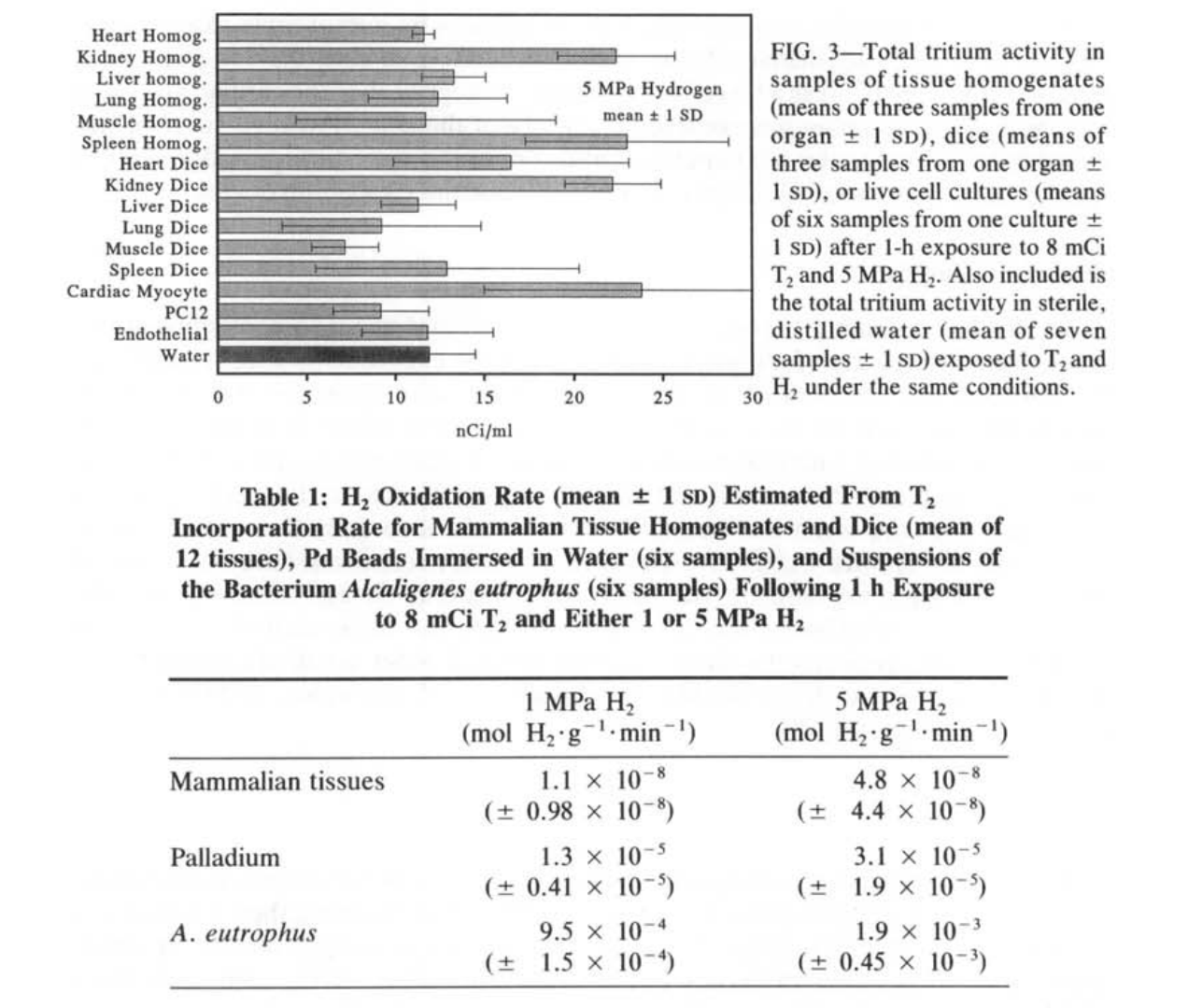
在每次实验中,盐水和蒸馏水对照盘中都存在类似的氚活性。方差分析(ANOVA)表明,在每个实验中,各种组织盘与盐水对照盘之间没有显著差异(P=0.11, F=1.86, df=6 at 1 MPa, and P=0.29, F=1.26, df=6 at 5 MPa)。实验之间的氚背景有超过2倍的变化性,这一变化性是通过在每次实验的盐水盘中发现的活性来确定的。哺乳动物组织实验中的活性通过从每次实验的组织盘中减去该实验的盐水盘中发现的活性来对背景变化进行标准化。对标准化数据进行的ANOVA表明,不同组织之间没有显著差异(P=0.13, F=1.58, df=14 at 1 MPa, and P=0.24, F=1.32, df=14 at 5 MPa),或者在任何组织和作为自身实验分析的蒸馏水之间也没有显著差异(P=0.18, F=1.43, df=15 at 1 MPa, and P=0.14, F=1.51, df=15 at 5 MPa)。因此,我们没有检测到哺乳动物组织的氢气氧化能力,灵敏度限制为100nmolH₂·g⁻¹·min⁻¹(5 MPa H₂的平均值+1sD; 表1)。
相比之下,钯珠和A.eutrophus菌悬液在1和5 MPa时摄入的氚活性比哺乳动物组织高出几个数量级(图4和5)。这种活性在1和5 MPa H₂的正控制中都在10μCi·ml⁻¹的范围内。对应的质量特定单位值为100nmol T₂·g⁻¹细菌和1 nmol·T₂·g⁻¹Pd。在我们使用的T₂在H₂中的稀释度下,计算得出的H₂氧化量为1-2 mmol H₂·g⁻¹细菌·min⁻¹和10-30μmolH₂·g⁻¹Pd·min⁻¹,这是在恒定压力加上解压时间的1小时期间(表1)。
讨论
无论是在1 MPa还是5 MPa H₂的条件下,所研究的豚鼠、大鼠和猪的各种组织都没有摄入比各种水对照盘中也摄入的微量T₂更多的T₂。因此,我们发现在高浓度和高压力的H₂暴露下,多种哺乳动物组织没有可检测的氧化H₂的能力。
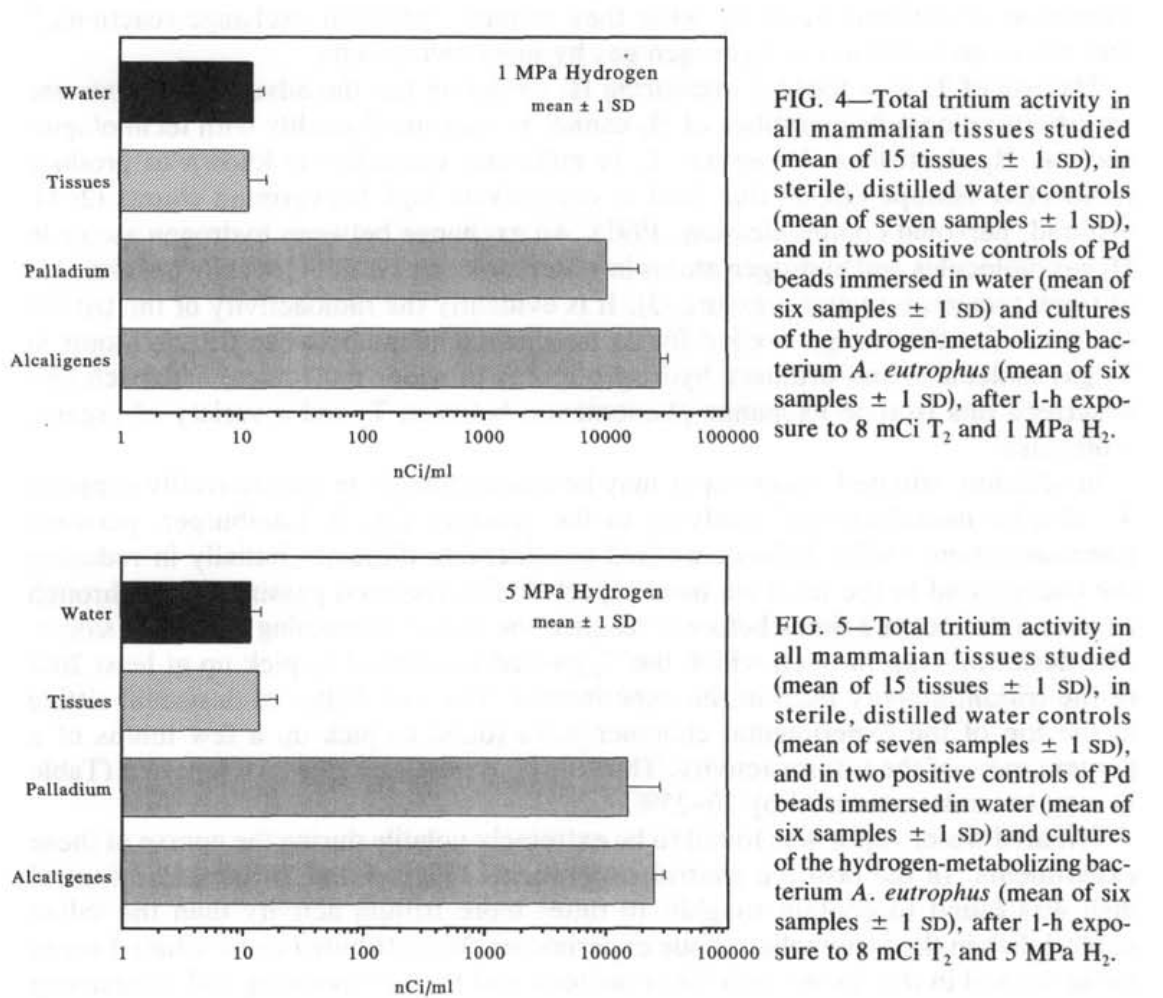
我们的阳性对照,即浸在水中的钯和A.eutrophus菌悬液中发现了更多的氚活性。这些阳性对照表明,我们的设备和实验方案足以证明H₂的氧化作用。我们估计的细菌悬液的H₂氧化速率(表1)非常接近于在1大气压条件下用氢气冒泡的A.eutrophus菌悬液通过分光光度计法计算得出的1.6 mmol H₂·g⁻¹·min⁻¹的速率(未发表的数据)。
我们向所有组织和对照暴露的8 mCi T₂在水中的溶解度为11.3 pmol·ml⁻¹(685 nCi·ml⁻¹)。阳性对照中高活性的氚表明T₂正在扩散进入这些样本并被氧化。在钯的情况下,T₂被氧化成水;在细菌悬液中,氚可能已经结合到水或某些有机分子中。哺乳动物组织中留下的低活性氚代表了加压室内物理溶解的T₂气体的数量。在这种闪烁计数器中,氚的背景活性大约是每分钟50次衰变,或每个闪烁鸡尾酒小瓶0.23 pCi。因此,与使用的T₂数量相比,哺乳动物组织样本和水对照中发现的氚标记量非常低,但高于未暴露于T₂时的背景。
Smith等人(2)在低浓度和1大气压条件下将大鼠的组织暴露于T₂。他们发现的氚掺入量与本研究中哺乳动物组织发现的数量级相同,在校正使用的T₂数量差异后。Smith等人(2)将这种微量掺入归因于他们所说的“物理交换反应”形成的氚化水,而不是哺乳动物细胞对氢气的氧化。
使用T₂作为测量H₂氧化的工具具有极高的灵敏度优势;使用诸如H₂电极等技术无法轻易测量皮克摩尔数量级的H₂。然而,已知毫居里数量级的T₂会产生放射性同位素效应,导致虚假的高背景计数(2;G. Östlund, 个人通讯,1991)。在室温和压力下,H₂气体分子中的氢原子与水分子中的氢原子之间的交换在能量上是不利的(3)。显然是氚的放射性提供了T₂气体分子中的氚原子与水分子中的普通氢原子之间同位素交换所需的能量。Wilzbach(20)描述了T₂与各种有机分子之间的这种同位素交换现象。
此外,尽管制造商的分析结果相反,商业供应的T₂中可能存在氚化水蒸气污染物(21;P. Lamburger, 个人通讯,1992)。实际上,我们最初在将背景降至我们报告的水平方面遇到了相当大的困难;这需要在T₂到达含有组织或盐水的盘子之前,通过或超过干燥剂3次。T₂通过的干燥剂阱被发现至少捕获了实验中使用的氚活性的20%。位于实验舱顶部的两个干燥剂盘被发现捕获了百分之几的氚活性。因此,我们报告的H₂氧化值(表1)可能被低估了20-25%。
在这些实验过程中,我们发现氚化水蒸气极其易挥发。在阳性对照实验中(图4和5),盐水对照盘被发现含有的氚活性大约是哺乳动物组织实验中盐水对照盘的10倍。我们认为这归因于在含钯或细菌的盘中形成的氚化水蒸发并凝结到盐水盘中。当这样的实验被封存几天后,所有的盘在其氚活性上彼此达到平衡。
我们所使用技术的局限性有几点。第一个局限性是我们不得不选择是在1和5 MPa的实验中使用相同的辐射剂量,还是在5 MPa的实验中使用5倍的T₂。我们选择了前者的策略,遵循的逻辑是,只有当T₂剂量恒定时,不期望但不可避免的放射性同位素效应才能保持恒定。在任何实验中使用的T₂在H₂中的实际稀释主要是方便的问题,并且当从放射性计算H₂氧化值时(表1)可以容易地用数学处理。
我们没有方法在室内搅动气体,不能保证T₂和H₂在整个室内完美混合。然而,在任何一个实验中,盘子的位置对T₂含量都没有影响。这表明T₂在整个室内均匀混合。如果存在任何气体分层现象,那么从室内多个盘子平均数据应该消除了偏差。当测试两种不同的组织时,它们的盘子以交替位置堆叠,盐水对照盘位于堆栈中央,以尽量减少这个潜在问题。
另一个局限性是,为了安全操作我们的装置,我们需要先将T₂加入实验室,几分钟后再加入H₂。对于已知在1大气压条件下不会代谢H₂的哺乳动物组织来说,这不应该构成问题。然而,Pd和细菌悬液可能在只有T₂一种氢气形式存在时开始氧化T₂,假设没有启动氧化所需的氢气分压阈值。在压缩阶段,T₂和H₂并未处于它们最终的相对浓度。如果它们的相对浓度不断变化,那么在此期间T₂的任何氧化都不会准确反映H₂氧化速率。因此,这些阳性对照的H₂氧化计算(表1)可能是超出未知幅度的高估。我们对这些阳性对照的意图不是准确量化它们的活性,而是至少定性地证明我们的装置可以检测到氢气氧化。
还有一个问题是,我们如何决定处理从1 MPa减压0.5小时和从5 MPa减压2小时的不等时间。在减压过程中,组织和对照受到与恒定压力下相同相对稀释度的T₂在H₂中的暴露,但它们也连续暴露于不断降低的T₂和H₂的分压。对于正在发生氢气氧化的阳性对照,我们将无法区分压力对氧化速率的影响与任何压力下的简单暴露时间,除非进行进一步的实验。如果我们错误地将2小时的减压时间加入到速率计算中,则在5 MPa实验中我们的H₂氧化值(表1)可能误差高达3倍。由于哺乳动物组织的T₂含量在任何压力下都未从它们的水对照中有所不同,所以这个问题不影响我们关于哺乳动物组织缺乏H₂氧化能力的结论,检测限仍在纳摩尔级H₂ "g⁻¹·min⁻¹的范围内。
我们得出结论,当各种豚鼠、大鼠和猪的组织在高浓度和高压的H₂中暴露于T₂时,组织中掺入的少量氚不比在相同条件下无菌蒸馏水或盐水中掺入的量更多。这种氚掺入归因于放射性同位素现象,它设定了测量H₂氧化的灵敏度限制为100 nmol H₂·g⁻¹·min⁻¹。因此,我们没有检测到哺乳动物组织在高压条件下氧化H₂的潜在能力。
https://blog.sciencenet.cn/blog-41174-1433854.html
上一篇:用互联网可提高幸福指数【进展】
下一篇:氢社会:从今天到将来