博文
肠道菌群与帕金森病的多向关联,从体液通路、细胞免疫通路和神经元通路的角度更新信息
|
肠道菌群与帕金森病的多向关联,从体液通路、细胞免疫通路和神经元通路的角度更新信息
Jia X, Chen Q, Zhang Y, Asakawa T. Multidirectional associations between the gut microbiota and Parkinson's disease, updated information from the perspectives of humoral pathway, cellular immune pathway and neuronal pathway. Front Cell Infect Microbiol. 2023 Dec 15;13:1296713
人类胃肠道中栖息着各种各样的微生物,统称为肠道微生物群,它们形成了一个庞大而复杂的生态系统。据报道,微生物群-肠-脑轴在调节宿主神经保护功能中起着至关重要的作用。研究表明,帕金森病(PD)患者存在肠道菌群失调,涉及无菌小鼠和PD患者粪便菌群移植的实验揭示了肠道菌群在PD中的致病作用。 针对PD肠道菌群的干预措施,包括使用益生元、益生菌和粪便菌群移植,也显示出治疗PD的疗效。然而,肠道菌群与帕金森病之间的因果关系仍然错综复杂。本综述从体液通路、细胞免疫通路和神经元通路的角度综述了微生物群-肠-脑轴与PD的相关性。我们发现肠道菌群和PD之间的相互作用非常复杂,应该是“多向的”,而不是传统意义上的“双向”。为了实现肠道菌群相关机制在临床环境中的应用,我们提出了未来研究中应解决的几个问题。
1 前言
帕金森病 (PD) 是主要的运动障碍和第二大神经退行性疾病 (NDD),预计未来 20 年患者人数将增加一倍以上。晚期患者的日常生活活动 (ADL) 和生活质量 (QOL) 受到显着影响,然而,更多的官方治疗方法正在开发中。到目前为止,多巴胺能药物和深部脑刺激 (DBS) 等手术疗法仍然是对抗 PD 的主要治疗方法。自 1967 年左旋多巴和 1993 年 DBS 出现以来,在新疗法方面没有革命性的突破。由于帕金森病极其复杂和多重的病理生理机制,很难获得一种新颖但令人满意的治疗方法,目前尚不清楚。因此,厘清PD相关机制一直是全球PD研究者面临的一项紧迫任务。尽管许多研究人员试图从多维度解释帕金森病相关机制,但导致大量黑质中多巴胺能神经元凋亡的实质性发病机制(我们称之为“神经毒性环境”)仍然错综复杂。衰老相关的神经退行性变似乎是许多帕金森病相关变化的合理解释。然而,衰老因素并不能阐明那些年轻时发病的帕金森病患者。许多动物模型是根据已知的神经毒素建立的。不幸的是,这些模型都不能完全模仿人类的PD,这意味着神经毒素可能不是这种“神经毒性环境”的主要原因。这似乎表明,“神经毒性环境”是由许多因素构成的。PD是这些因素之间复杂相互作用/串扰的最终综合结果。除了传统的环境和遗传致病因素外,最近,肠道微生物群和相关微生物群-肠-脑轴的作用开始出现,特别是随着高通量测序的发展。
詹姆斯·帕金森(James Parkinson)甚至注意到了胃肠道(GI)功能障碍与帕金森病之间的关系,他于1817年首次报告了帕金森病。据报道,在 80% 的早期 PD 患者中始终发现胃肠道功能障碍。肠道微生物群代表了居住在胃肠道中的一大群细菌。肠道菌群基因的总量约为人类基因的100倍,被称为人类的“第二基因组”。利用高通量测序等技术,微生物群-肠-脑轴的研究进入了一个新时代。近年来,越来越多的研究阐明了肠道菌群的PD相关代谢变化与PD的发生和发展密切相关。这些“受损”的肠道微生物群及其相关代谢物被认为主要通过微生物群-肠-脑轴与宿主相互作用,并最终成为PD的致病因素。此外,许多后来的研究表明,肠道微生物群可以被视为 PD 的诊断/治疗生物标志物,或显示 PD 进展的生物标志物。然而,由于肠道菌群的特性,有时很难进行定向的相互作用来改变肠道菌群的行为。因此,基于肠道菌群相关机制开发抗帕金森病的药物是相当困难的。最近,Tan 和她的同事发表了一项有见地的研究,讨论了有关微生物组-肠道-脑轴和 PD 的现有证据。这项研究通过微生物组-肠道-脑轴批判性地回顾了大脑和肠道之间的复杂相互作用/串扰。基于本研究,我们从体液通路、细胞免疫通路和神经元通路的角度重点研究肠道菌群与PD的关联。我们试图提供有关该主题的更广泛和更新的信息。我们相信,这些带回家的信息将加深对肠道微生物群在帕金森病中的作用的理解,并将有助于开发基于肠道微生物群的针对帕金森病的新型诊断/治疗靶点。
在临床上,许多帕金森病患者患有胃肠道功能障碍,这可能是引起临床医生注意研究胃肠道在帕金森病中的作用的第一个值得注意的症状。事实上,无论是胃肠道功能障碍导致胃肠道功能障碍,还是相反,帕金森病导致胃肠道功能障碍都是一个先有鸡还是先有蛋的问题。尽管越来越多的证据表明肠道菌群失调在帕金森病的发展中起致病作用,其中微生物群-肠-脑轴起着关键作用,但如今,主流观点认为帕金森病和肠道菌群之间的关联是双向的:当然,肠道菌群的菌群失调可能导致 PD 的发展,而胃肠道功能障碍可能是 PD 的非运动症状。 重要的是, 肠道菌群失调与PD病理生理学表现出复杂的相互作用,并全面驱动PD的进展。
2.1 帕金森病受试者肠道菌群失调
帕金森病患者可能会出现许多胃肠道功能障碍的症状,例如便秘、胃排空延迟、排便习惯改变和恶心。事实上,这些症状已被注意到是帕金森病的非运动症状。据报道,帕金森病患者通常伴有幽门螺杆菌感染和消化性溃疡。有趣的是,当患者来源的 α-突触核蛋白 (α-syn) 立体定向注射到非人灵长类动物的纹状体或肠神经中时,这两种注射都会导致黑质纹状体通路和肠神经系统病变。这一发现表明,暴露于α-syn可能导致病理变化,不仅在大脑中,而且在胃肠道中。大量研究揭示了帕金森病肠道菌群的异常,与这些研究中的健康受试者相比,帕金森病患者肠道菌群的结构和功能有很大不同(表1)。异质性结果表明,肠道菌群的变化受到许多复杂因素的影响,例如年龄、地理来源、饮食习惯、研究方案和测序方法。其中,据报道,PD 患者的 Akkermansia 增加。同时,据报道,双歧杆菌的丰度增加。观察到 Roseburia 和 Prevotella 在 PD 患者中显着减少,并观察到普雷沃氏菌减少,这与 PD 发病机制呈负相关。此外,许多研究表明肠道菌群失调与 PD 相关的临床表现(如 PD 严重程度、持续时间、运动和非运动症状)之间存在密切关联。
换句话说,在PD动物模型中也观察到肠道微生物群的失调(表2),尽管现在所有可用的动物模型都不能完全模仿PD患者的病理生理变化。与 PD 患者类似,Akkermansia 也有所增加,而据报道,在这些动物模型中,普雷沃氏菌的丰度下降。与人类患者的情况类似,动物模型中肠道微生物群的变化也受到许多因素的影响,例如使用的神经毒素以及给药方法、剂量和时间。
一些作者认为,特定的肠道菌群可能被认为是帕金森病的潜在标志物和治疗靶点,因为帕金森病相关肠道菌群的变化与帕金森病的发生和发展密切相关。然而,由于这些结果的异质性,无论是在人类患者还是动物模型中,到目前为止,仍然没有令人信服的证据支持哪种肠道微生物群可以作为PD的诊断/治疗靶点。此外,上述结果来自在不同实验条件下对小样本的研究。此外,他们无法回答先有鸡还是先有蛋的问题,即PD的病理生理变化是否会导致肠道菌群失调,反之亦然。因此,在我们得出肠道微生物群在帕金森病中的作用之前,需要进行更深入和严格的研究。
2.2 肠道菌群在神经功能中的调节作用
大脑和肠道微生物群之间的相互作用/串扰越来越受到关注。肠道微生物群生活在正常人相对平衡的环境中,这可能有助于调节学习、认知和记忆等神经功能。Cryan 等人报告说,肠道微生物群可以调节智力和行为发育,并与一些神经系统疾病有关。最近的一些研究证明,肠道微生物群的完全缺失或严重耗竭可能导致宿主的学习和记忆受损。Olson等人发现,生酮饮食和缺氧的共同治疗可以改变富含Bilophila wadsworthia的肠道微生物群,然后促进无菌(GF)小鼠的认知障碍。Wu等人报道,粪肠球菌可以通过离散的神经元回路影响社会行为,并介导GF小鼠的应激反应。
在帕金森病的情况下,许多研究还阐明了帕金森病与肠道菌群之间的密切关联。Sampson等人报告说,肠道微生物群调节α-syn过表达小鼠的运动缺陷和神经炎症。重要的是,一旦将来自PD患者的肠道微生物群移植到这些模型中,神经功能缺损就会显着增强。Wekerle报告说,大肠杆菌和鼠伤寒沙门氏菌可能诱导Curli蛋白的分泌,并触发老年Fischer 344大鼠和秀丽隐杆线虫中α-syn的积累。后来,Sun等人发现粪便微生物群移植(FMT)导致小胶质细胞活化减弱,短链脂肪酸(SCFAs)减少并导致运动缺陷。临床上,已经证明肠道微生物群可以影响 PD 的严重程度。
上述这些报告从多个维度表明帕金森病与肠道微生物群之间存在密切联系。然而,阐明帕金森病和肠道菌群的直接证据仍然不足。在这方面,讨论PD与肠道菌群相互作用中涉及的几个因素的潜在作用是必不可少的。
2.3 微生物群-肠-脑轴的作用
最近,Tan 等人回顾了微生物群-肠道-大脑在 PD 情景中的潜在作用。事实上,微生物群-肠-脑轴在肠道微生物群和大脑之间的相互作用中起着关键作用。已知至少有四个系统参与微生物群-肠-脑轴的调节,即中枢神经系统(CNS)、自主神经系统(ANS)、下丘脑垂体肾上腺(HPA)轴和肠神经系统(ENS)。炎症信号的传递在大脑和肠道微生物群之间的相互作用中起着关键作用。传统理论认为肠道菌群失调可能诱发外周炎症,炎症信号可以通过这些途径传递到大脑中,从而引起中枢神经系统的炎症反应,最终在大脑中形成“神经毒性环境”,这可能是导致帕金森病的致病因素。然而,没有直接证据证明肠道菌群失调可能导致帕金森病。引入了几种假设的途径,促进了大脑、肠道和微生物群之间的炎症相互作用,包括体液途径、细胞免疫途径和神经元途径。然而,这些通路在PD病理生理学方面也存在问题(图1)。
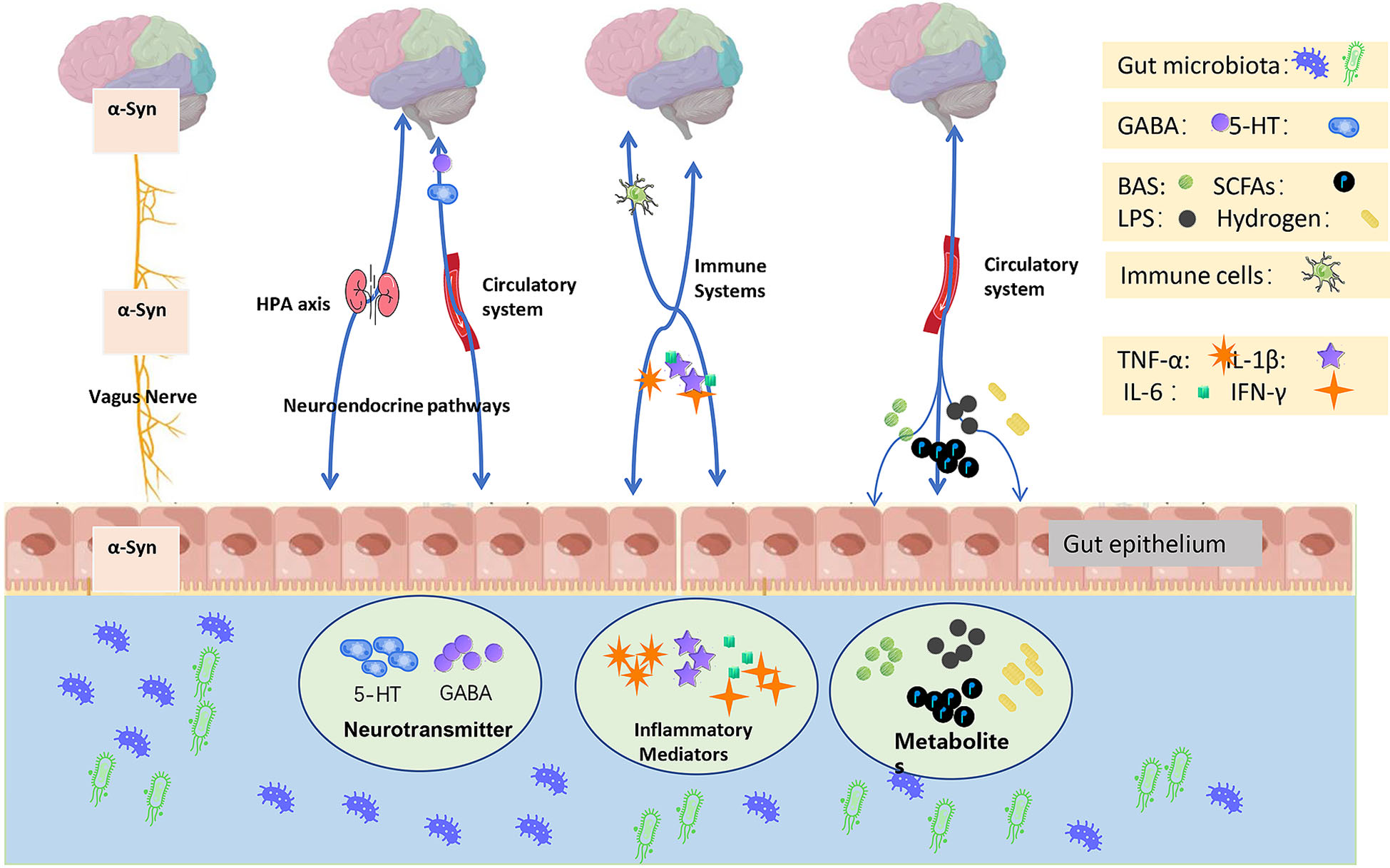
2.3.1 体液通路
Agirman 等人介绍,肠道菌群的生态失调可能会触发促炎细胞因子的释放并破坏血脑屏障 (BBB) 的完整性,然后形成一个门户,可能将外周毒素和病原体引入大脑并引起神经炎症。同时,这种神经炎症可能会引发糖皮质激素的释放,使肠道菌群的环境恶化。这些双向规定造成了恶性循环。然而,该途径主要基于BBB损伤。如果血脑屏障相对完整,则中枢神经系统与外周血之间的相互作用受到限制。尽管最近的一份报告表明在患有痴呆的帕金森病中发现了BBB损伤,但没有直接的临床证据表明帕金森病的BBB损伤没有认知障碍,特别是在帕金森病的早期阶段。 因此,除了细胞因子外,脂溶性小分子可能在体液途径中发挥更重要的作用, 例如色氨酸-犬尿氨酸途径 (KP)、SCFA 和胆汁酸 (BA) 中的代谢物。
2.3.1.1 色氨酸代谢物的作用
色氨酸是一种必需氨基酸,大约95%以上通过KP代谢,而不到5%产生5-HT。 重要的是,KP和5-HT中的代谢物都被证明与PD病理生理学密切相关。
2.3.1.1.1 KP和PD
最近,我们回顾了 KP 在 PD 致病性中的作用。肠道菌群的衰老和生态失调都可能激活 KP 中的一些限速酶,例如吲哚胺 2,3-双加氧酶 1 (IDO1) 和色氨酸 2,3-双加氧酶 (TDO)。KP的活化将导致下游毒素的增强,如3-羟基犬尿氨酸、3-羟基邻氨基苯甲酸、喹啉酸。虽然这些毒素主要在外周产生,但脂溶性与小分子量使它们容易穿过血脑屏障并积聚在中枢神经系统中,从而表现出神经毒性作用。因此,在血脑屏障保持不间断的状态下,KP可能充当“衰老信号传递者”,特别是将炎症信号从外周传递到中枢神经系统。KP、α-syn 和 PD 之间的密切关联在本综述中得到了很好的记录。然而,仍然没有直接证据表明 KP 的激活会导致 α-syn 沉积并最终导致 PD。
2.3.1.1.2 5-HT的作用
作为色氨酸代谢的次要产物,5-HT不能直接穿过BBB。因此,在血脑屏障未中断的情况下,中枢神经系统中的 5-HT 是在中枢神经系统中产生的。许多研究报告了5-HT与肠道菌群之间的密切关联。据记载,海马5-HT及其主要分解代谢产物水平增加,而血浆色氨酸和通过KP的色氨酸代谢在GF小鼠中降低。动物实验表明,在GF小鼠中施用抗生素后,结肠和粪便中的5-HT水平降低,但肠道微生物群的重建恢复了这些动物的5-HT水平。Desbonnet等人发现,婴儿双歧杆菌可以增加血浆色氨酸水平,这可能会影响中枢5-HT传递。这些结果表明,5-HT受肠道菌群的显着影响。一些肠道菌群可能会增强外周色氨酸水平,从而可以穿过血脑屏障,随后增加中枢神经系统中的色氨酸水平,最后增加中枢神经系统中的5-HT水平。在5-HT和PD的联系方面,Tong等人发现PD患者的血浆5-HT水平低于健康对照组,并且5-HT水平与抑郁和疼痛等非运动症状的严重程度呈负相关。Kotagal 等人发现 5-HT 可能会改变 Aβ 代谢并降低 PD 相关认知障碍的风险。Lelieveld 等人报道,5-HT 可能会影响 PD 的睡眠呼吸障碍。这些发现似乎暗示了 5-HT 与 PD 中非运动症状之间的潜在关联,然而,需要进一步验证。
2.3.1.1.3 色氨酸代谢物SCFAs的作用
短链脂肪酸,如乙酸、丙酸、丁酸、异丁酸、戊酸和异戊酸,通常由肠道微生物从肠道微生物发酵膳食纤维中产生。据记载,双歧杆菌、梭状芽胞杆菌、乳酸杆菌、拟杆菌和粪杆菌可产生短链脂肪酸。短链脂肪酸作为结肠细胞的主要营养物质,在维持肠道稳态和调节能量代谢方面发挥着重要作用。最近,短链脂肪酸被提议作为微生物群-肠道-大脑相互作用的关键介质。短链脂肪酸通常在肠道中产生。它们可以穿过血脑屏障,从而可以调节外周和中枢神经系统的炎症反应。在外周,短链脂肪酸有助于调节肠道通透性和增强肠道屏障的完整性。Kim等人发现,SCFAs激活肠上皮细胞上的G蛋白偶联受体(GPR)41和GPR43,导致趋化因子和细胞因子的产生,并介导小鼠的保护性免疫和组织炎症。丁酸盐给药可以影响紧密连接蛋白的表达,从而维持肠屏障的完整性)。此外,丁酸盐给药可以通过GPR109A(一种 G 蛋白偶联受体)增加紧密连接蛋白的水平并改善肠道通透性。在中枢神经系统中,短链脂肪酸对血脑屏障具有类似的保护作用。Braniste等人报道,施用丁酸梭菌(主要产生丁酸盐)和拟杆菌(主要产生乙酸盐和丙酸盐)导致额叶皮层,海马体和纹状体中BBB通透性降低,同时GF小鼠闭塞蛋白表达上调,表明对BBB具有保护作用。此外,短链脂肪酸与免疫细胞相互作用,有助于减少全身炎症,随后缓解神经炎症。此外,SCFA不断调节中枢神经系统中小胶质细胞的成熟和功能。这些发现表明短链脂肪酸具有神经保护作用。
Aho等人发现,与健康人相比,帕金森病患者的短链脂肪酸水平较低,这与胃肠道炎症和帕金森病的发展有关。另一项研究发现,在帕金森病患者的乙状结肠粘膜中,产抗炎丁酸盐的细菌(如 Blautia、Coprococcus 和 Roseburia 属)较低,而 Ralstonia 属的促炎变形菌较高(与健康对照组相比)。因此,他们验证了肠道微生物群促炎菌群失调在PD病理生理学中的参与,特别是在炎症诱导的α-syn错误折叠中。这些人类结果似乎暗示了 SCFA 对 PD 的神经保护作用,这也得到了几项体外研究的验证。目前动物研究的证据也证明了短链脂肪酸对帕金森病受试者的显着影响。然而,这些结果在研究中是有争议的。Hou等人发现,在1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)治疗的小鼠PD模型中,丁酸钠的施用实现了神经炎症的抑制和神经功能缺损的缓解。后来,他们还发现,口服肠道微生物群衍生的丙酸酯可改善 6-羟基多巴胺 (6-OHDA) 诱导的小鼠 PD 模型中的运动缺陷和多巴胺神经元的耗竭。相反,Cannon等人发现Pink1-/-PD小鼠中丁酸水平的增强和异丁酸水平的降低。Qiao 等人发现,丁酸钠的给药通过增加小胶质细胞和活化星形胶质细胞的数量导致运动缺陷和神经炎症的恶化。这些相互矛盾的结果表明,在PD条件下,SCFAs具有极其复杂的性质。短链脂肪酸是否发挥神经保护作用或神经毒性作用的问题仍需进一步研究。
2.3.1.1.4 色氨酸代谢物BAs的作用
BAs由肝细胞合成,并通过胆管分泌到肠道。在末端回肠和结肠肠道微生物群的作用下,原发性 BA 转化为继发性 BA。BA 可以跨越 BBB。据报道,BA分布在人类和动物的大脑中,其中在大鼠大脑中鉴定出约20个BA。鹅去氧胆酸(CDCA)和胆酸(CA)是大鼠大脑中的主要BA。BA可以影响中枢神经系统的免疫调节。目前,许多研究证明了 BA 在几种神经系统疾病中的潜在神经保护作用。许多研究已经证明了 BA 在各种神经系统疾病中的潜在神经保护作用。此外,已发现 BA 参与学习和记忆等认知功能。例如,成年大鼠脑室内牛磺熊去氧胆酸(TUDCA)的给药显着增强了早期神经发生。在PD小鼠模型中,TUDCA通过调节Akt信号传导来防止中脑和纹状体中的JNK磷酸化,并防止MPTP诱导的多巴胺能细胞死亡。此外,在使用SH-SY5Y细胞的体外实验中,发现TUDCA激活Nrf2以防止1-甲基-4-苯基吡啶和α-syn诱导的氧化应激。据报道,在另一项实验中,TUDCA 通过增加 PINK1、parkin 和 LC3-II/LC3-I 的表达来诱导线粒体自噬。在PD的转基因小鼠模型中,TUDCA减少了纹状体细胞凋亡并改善了运动能力。有趣的是,TUDCA 给药改善了 db/db 小鼠的认知障碍。此外,UDCA在PD的鱼藤酮模型中被发现具有抗炎潜力,降低鱼藤酮诱导的NF-κB表达和TNF-α水平。据报道,在重度抑郁症的研究中,激活胆汁酸受体FXR(法尼醇X受体)可以调节神经免疫并抑制脑部炎症。最新研究表明,BA 的衍生物奥贝胆酸 (OCA) 降低了海马中神经炎症小胶质细胞和 IL-1 的表达。几项研究表明,BA 可能在认知功能障碍中发挥作用。总之,BAs可能通过抗炎和神经免疫调节机制对PD产生影响。
众所周知,BA和肠道微生物群是相互影响的。通常,BA被微生物通过某些酶促反应修饰。不难理解,PD背景下肠道菌群的异常状态可能会影响BAs的修饰。然而,直接证据仍然不足。先前的研究报告说,几种含胆盐水解酶的细菌,如拟杆菌属、双歧杆菌属和乳酸杆菌属,在帕金森病患者中增强,表明 PD、微生物群和 BA 之间存在复杂的关联,目前尚不清楚。Wang 等人记录了 BA 可能在微生物群-肠-脑轴的机制中发挥“明星分子”的作用,该机制涉及肠道微生物群和 PD 之间的相互作用。(5)色氨酸代谢产物γ-氨基丁酸的作用。
GABA(γ-氨基丁酸),也称为4-氨基丁酸,是一种非蛋白质氨基酸,是哺乳动物中枢神经系统中的主要抑制性神经递质。除脑组织外,GABA还存在于心脏,胃,小肠,肝脏和肾脏等外周组织中。GABA具有抗氧化、抗惊厥、抗炎、镇痛、镇静和抗焦虑特性,据报道可增强大脑和神经系统功能,以及认知和记忆功能。最近的研究发现,肠道微生物群(拟杆菌属、副拟杆菌属、大肠杆菌属、乳酸杆菌和双歧杆菌)产生的GABA可以通过微生物群-肠-脑轴参与神经活动。一项使用益生菌的动物实验发现,鼠李糖乳杆菌(JB-1)可以通过迷走神经诱导大脑中GABA mRNA表达的区域依赖性变化,并减少压力诱导的皮质酮和焦虑和抑郁相关行为。发现GF小鼠粪便和血液中的GABA水平显着降低,并且发现抗生素会改变粪便中GABA的水平,这表明微生物群可能有助于GABA的循环水平。一项关于秀丽隐杆线虫的研究发现,大肠杆菌HT115产生的GABA对神经元具有保护作用。而之前一项关于蜜蜂学习的研究报告称,用可遗传的双歧杆菌菌株定植的蜜蜂的大脑显示出GABA水平升高。文献报道,GABA在保护肠道屏障和预防胃肠粘膜炎症方面起着至关重要的作用。GABA可能有助于调节肠道微生物群的数量和多样性,例如增强优势微生物种群,丰富微生物群落。此外,GABA可以通过提高乙酸盐,丙酸盐,丁酸盐和总短链脂肪酸的水平以及降低结肠和盲肠pH值来改善结肠健康)。最近的临床试验和动物研究表明,GABA在PD的发病机制中起着重要作用。一项检查帕金森病患者和健康对照组GABA水平的实验发现,帕金森病患者上脑干的GABA水平明显低于健康对照组。而一项初步研究还发现,单剂量的左旋多巴会增加帕金森病中的上脑干GABA。一些专家认为,PD患者的GABA水平降低可能与GABA能功能障碍有关。动物实验还报道,聚甘露糖醛酸通过PD小鼠的微生物群-肠道-脑轴调节GABA水平,以防止多巴胺能神经元的丢失。基于上述信息,我们可以假设GABA在微生物群-肠-脑轴介导的PD发病机制中起重要作用。
2.3.1.2 LPS的作用
LPS,也称为内毒素,是革兰氏阴性细菌外膜的一个组成部分。微生物群的失调导致肠道通透性增加,使LPS产品从肠腔转移到宿主循环中。多项研究发现,帕金森病患者革兰氏阴性菌显著增加,这与肠道炎症密切相关。此外,一项研究发现革兰氏阴性肠杆菌科的相对丰度与姿势不稳定和步态困难的严重程度之间存在正相关。一项动物实验表明,将LPS注射到大鼠黑质中可以激活小胶质细胞,触发炎症反应,增加促炎细胞因子的表达,并改变氧化应激标志物的活性,诱导PD模型的表征。LPS给药的不同途径和模式可引起各种帕金森病症状。腹膜内注射LPS可以增加大肠和肠道通透性中α-Syn的表达。内毒素诱导的PD模型可以通过LPS的单侧鼻内滴注来建立。这些小鼠表现出进行性运动功能减退,多巴胺能神经元的选择性丧失,纹状体中多巴胺(DA)含量降低,以及没有全身炎症和免疫反应的α-Syn聚集体。直肠内注射源自奇异疟原虫的LPS可诱导大脑黑质纹状体区域的炎症。PD 患者的肠活检显示肠道通透性增加与肠道 α-syn 和 LPS 之间存在密切关系。此外,一系列体外和体内实验证明了LPS与肠道通透性以及相关炎症信号之间的关系。先前的研究表明,用 LPS 引发的炎性单核细胞可以内化 α-syn,这反过来又促进了其从外周向大脑和脊髓的传播。综上所述,推测LPS释放炎症因子并诱导α-syn在肠道中积累,然后通过循环系统到达大脑,导致PD相关的病理变化。
2.3.1.3 氢的作用
氢气是肠道细菌发酵的代谢产物,已被证明具有选择性抗氧化和抗炎作用(Levitt,1969;Ohsawa 等人,2007 年)。此外,已发现它具有抗凋亡和细胞保护特性,对细胞保护有显着贡献(Xie等人,2010;Dixon等人,2013)。据报道,在PD的大鼠模型中,用氢气治疗具有神经保护作用并防止了多巴胺能细胞损失(Fu等人,2009)。小鼠模型和PD患者也显示出相似的发现(Fujita等人,2009;Yoritaka 等人,2013 年)。一项动物实验表明,饮用氢水和间歇性氢暴露可以预防6-羟基多巴胺诱导的大鼠PD(Ito等人,2012)。此外,有证据表明,H2 的产生和氧化有助于维持肠道微生物组的多样性(Hylemon 等人,2018 年)。一项研究发现,益生菌可以促进肠道产生氢气并改善 C57BL/6J 小鼠的代谢综合征(Zhao 等人,2019 年)。对 16S rRNA 基因分离株的分析表明 PD 患者中产氢细菌的丰度较低(Hasegawa 等人,2015 年)。气相色谱测量显示,与对照组相比,帕金森病患者的肠道产氢量低 2.2 倍(Suzuki 等人,2018 年)。一项临床试验发现,口服乳果糖可以增加帕金森病患者的氢浓度(Ito等人,2012)。随后的研究提供了证据表明乳果糖可能会增加肠道微生物群的氢产生(Ohno等人,2012)。这些发现表明,肠道产氢菌的丰度可能与帕金森病的发生和发展有关。因此,肠源性氢气可作为帕金森病诊断、预后和治疗反应的新型候选非侵入性生物标志物。
2.3.2 免疫系统通路
众所周知,免疫系统,无论是先天免疫系统还是适应性免疫系统,都与肠道菌群密切相关。肠道菌群在维持肠粘膜屏障方面起着关键作用,并有助于免疫系统的维持和发展。肠道微生物群的免疫功能在肠道中启动,然后在免疫反应期间调节全身免疫。许多早期研究证明,从小肠植入分段丝状细菌导致肠 B 和 T 淋巴细胞免疫功能的恢复。后来,Forsythe发现肠道微生物的植入实现了免疫功能的重建,这在GF小鼠中是缺乏的。然而,在血脑屏障未断裂的情况下,中枢神经系统和外周器官的免疫反应是相对独立的。由于上述PD中的BBB状态,在这里,我们只讨论CNS中固有的细胞免疫通路。
2.3.2.1 小胶质细胞
小胶质细胞是中枢神经系统中的关键免疫细胞,有助于抗原的呈递、细胞因子的产生和炎症的激活/调节。许多研究已经阐明,小胶质细胞受到肠道微生物群变化的显着影响。Erny等人发现,GF小鼠中未成熟小胶质细胞的比例在GF小鼠中增加。有趣的是,一旦这些GF小鼠的肠道微生物群被恢复,小胶质细胞的特征就会相应地恢复。或者,敲除小胶质细胞特异性基因MafB上调成年GF小鼠炎症通路的表达。Song等人发现,肠道菌群失调导致衰老大鼠海马中小胶质细胞活化和TLR4 / NF-κB炎症通路的上调受到抑制。因此,FMT的治疗可以缓解肠道微生物群的生态失调,并导致小胶质细胞活化的抑制。这些结果揭示了小胶质细胞和肠道微生物群之间的密切相互作用,甚至上述实验也使用了BBB似乎未被破坏的动物。许多作者认为,小胶质细胞和肠道微生物群之间的双向相互作用可能在神经退行性疾病的病因中发挥作用。在PD情景中,这一假设也得到了许多实验的支持。Sampson等人证明,肠道微生物群在α-syn过表达小鼠的运动缺陷,小胶质细胞激活和α-syn病理学中起作用。Fang 等人发现,使用表达胰高血糖素样肽-1 的小鼠品系 MG1363-pMG36e-GLP-1 治疗 MPTP 治疗的小鼠可改善运动缺陷、抑制小胶质细胞活化和炎症、减少病原体肠杆菌科,并增强益生菌乳酸菌和 Akkermansia.Joers等人用一种新型TNF抑制剂XPro1595处理PD猴模型。他们发现肠道微生物群的多样性、炎症和小胶质细胞行为也发生了相应的变化。Sun 等人发现,口服丁酸梭菌可改善 MPTP 治疗小鼠的运动缺陷、多巴胺神经元耗竭、突触功能障碍和小胶质细胞激活。这些实验通过各种处理和动物模型验证了PD条件下小胶质细胞与肠道菌群的密切关系。因此,克劳迪诺·多斯桑托斯等人最近评论说,炎症反应可能会激活小胶质细胞并诱导α-syn聚集,最终导致多巴胺能神经元受损,其中肠道菌群的生态失调起着关键作用。没有临床证据调查小胶质细胞在帕金森病患者肠道菌群干预中的作用。重要的是,没有研究观察到一旦干预帕金森病中的小胶质细胞,肠道微生物群的变化。小胶质细胞、PD和肠道菌群之间的复杂相互作用仍然错综复杂,需要在未来进一步研究。
2.3.2.2 星形胶质细胞
星形胶质细胞作为中枢神经系统中最丰富的细胞,在调节炎症和免疫反应性方面也发挥作用。星形胶质细胞和肠道微生物群之间的相互作用也有报道。Rothhammer等人报道,膳食色氨酸被肠道微生物群代谢成芳烃受体激动剂,然后作用于星形胶质细胞以抑制CNS炎症。Zhang等人发现,在动物抑郁模型中,NLRP3 KO肠道菌群的FMT通过抑制环状RNA HIPK2(circHIPK2)的表达,显著改善了抑郁样行为和星形胶质细胞功能障碍。因此,他们提出了抑郁症中的肠道微生物群-circHIPK2-星形胶质细胞轴。Sanmarco等人发现了一个星形胶质细胞亚群,LAMP1 + TRAIL +星形胶质细胞通过诱导T细胞凋亡来抑制CNS炎症,而这些LAMP1 + TRAIL +星形胶质细胞由微生物组许可的脑膜IFN + NK细胞维持。Margineanu等人报道,星形胶质细胞-神经元乳酸穿梭相关基因的海马表达受肠道微生物群的调节。另一项研究表明,更高水平的肠道微生物组衍生代谢物三甲胺 N-氧化物与脑促炎细胞因子和星形胶质细胞活化标志物的较高表达有关。这些研究还阐明了星形胶质细胞在中枢神经系统免疫调节中的关键作用。在PD方面,Sun等人发现FMT通过抑制神经炎症和减少黑质中的星形胶质细胞活化来保护神经元功能。另一项针灸研究发现,针灸对帕金森病小鼠调节肠道微生物群的丰度,并恢复了纹状体和黑质中星形胶质细胞的过表达。到目前为止,星形胶质细胞和肠道微生物群在帕金森病中的证据仍然有限。
2.3.2.3 炎症介质
在已知的范围内,PD和肠道菌群失调之间的调节是双向的。i) 肠道菌群失调可能导致与PD相关的异常炎症反应。肠道微生物群可以调节肠道中与免疫相关的炎症因子,并随后影响中枢神经系统。微生物群及其产物可以刺激肠道中的肠上皮细胞和巨噬细胞,导致免疫反应的激活和炎性细胞因子的释放,并且可以到达中枢神经系统。尸检时发现,PD患者的脑组织和脑脊液中促炎细胞因子和趋化因子的表达上调,包括TNF-α,IL-1β,IL-6和IFN-γ。TNF-α受体基因的敲除在小鼠中表现出神经保护作用。在生理条件下,肠道微生物群下调星形胶质细胞中IFN-γ表达,同时上调星形胶质细胞中TRAIL表达。肠道微生物群可以产生各种toll样受体(TLR)配体,这些配体可以在特定环境中发挥促炎作用。因此,肠道微生物群的任何变化和肠道上皮屏障的破坏都可能激活 TLR,并促进 PD 患者肠道和大脑的炎症反应。众所周知,TLR2 和 TLR4 的信号调节可以影响 PD 的发展。在PD患者的肠道中,发现结肠组织中CD3 + T细胞的增强以及TLR4,细胞因子和趋化因子之间的免疫相互作用。流行病学研究还表明,炎症性肠病是帕金森病发展的重要危险因素。一些学者假设肠道微生物菌群的改变导致胃肠道系统紊乱,从而通过朊病毒α-syn表达引起神经炎症并产生PD样症状。ii) 帕金森病可能有胃肠道功能障碍,这会恶化肠道菌群的状态。在早期的帕金森病患者中,通常会出现轻度肠道炎症,引发低水平的免疫反应并增加肠道通透性。因此,肠道炎症和增强的肠道通透性是帕金森病患者的肠道特征。这些问题明显破坏了肠道微生物群的平衡,恶化了它们的生态。因此,肠道微生态的失衡增加了肠道内的促炎环境,从而促进了中枢神经系统的神经炎症,导致了PD的发展。对此,PD和肠道菌群失调可能产生双向恶性循环,并促进PD的发生发展。
据报道,α-syn 错误折叠可能始于肠道,并通过迷走神经传播到大脑。这一假设为肠道微生物群对基于α-syn的PD发病机制的影响提供了一个合理的“途径”(见下一节)。然而,由于小胶质细胞、星形胶质细胞、肠道菌群和肠道胶质细胞之间相互作用的复杂性,我们认为PD与肠道菌群相关炎症反应之间的实际相互作用远比“双向”复杂。它可能涉及许多已知和未知因素的“多向”,这确实值得进一步研究。
2.3.3 神经元通路
2.3.3.1 迷走神经通路
迷走神经由第十对颅神经组成,是最长和分布最广泛的一对颅神经,包含感觉、运动和副交感神经纤维。它是肠道细菌和大脑之间的重要纽带,传递来自各种肠道的信号,并与许多胃肠道、神经系统和免疫系统疾病有关。迷走神经通过与脑干孤束核的多个突触连接与大脑沟通。据报道,当肠道菌群刺激ENS的传入神经元时,ENS和迷走神经形成突触连接和信息传递通路,使肠道菌群与大脑之间能够相互沟通和调节。研究还发现,迷走神经的感觉神经元沿着胃肠道形成各种机械和化学感觉末梢,以接收肠脑信号。此外,肠内分泌细胞可以与邻近神经形成突触,以帮助迷走神经接收来自肠道的信号。一项大型前瞻性队列研究发现,接受过完全迷走神经切断术的受试者患 PD 的风险较低。一项尸检研究表明,PD病理学可能从胃肠道开始,然后通过迷走神经扩散到大脑。一项动物研究发现,迷走神经截肢后鼠李糖乳杆菌的核心作用被消除。最近,α-syn已成为导致PD发病机制的关键因素。更多的证据表明,迷走神经是α-syn病理学可以传播到大脑和从大脑传播的途径。一种新的 PD 小鼠模型表明 α-syn 病理学通过迷走神经从肠道扩散到大脑。最近的进展表明,肠道细菌增强了α-syn和其他类似蛋白质的聚集,这种机制可能促进病原体通过迷走神经到达中枢神经系统的能力。然而,一些学者否认帕金森病与迷走神经之间的联系。一项以狒狒为模型的研究发现了一种可能的全身机制,其中全身循环将作为肠道和中枢神经系统之间内源性α-syn 长距离双向传播的途径。尽管积累了令人信服的证据支持这一途径,但其具体机制仍不清楚,需要进一步探索。
2.3.3.2 HPA轴通路
HPA轴是神经内分泌系统的重要组成部分,它调节各种身体过程以应对压力。在压力下,促肾上腺皮质激素释放因子(CRF)从下丘脑的室旁核(PVN)释放,下丘脑是HPA轴的主要调节因子,并诱导促肾上腺皮质激素(ACTH)释放到体循环中。随后,肾上腺皮质受到ACTH的刺激并分泌糖皮质激素。然后释放的糖皮质激素与糖皮质激素受体(GR)结合,导致反馈抑制。近年来,越来越多的研究通过HPA轴发现神经内分泌系统和肠道微生物群之间的双向通讯。中枢神经系统可以通过HPA轴调节肠道功能,肠道菌群也可以调节肠道激素水平,从而通过HPA轴影响中枢神经系统功能。使用GF小鼠的动物实验发现,粪肠球菌可以通过限制HPA轴介导的皮质酮水平的产生来抑制社会互动中的过度应激反应,从而促进小鼠的社会活动。使用GF和无病原体小鼠的实验表明,母体孤立的早期生活压力以不依赖微生物群的方式改变了HPA轴。此外,有证据表明,GF小鼠在压力下可以过度刺激HPA轴,而益生菌可以缓解小鼠HPA轴的反应状态。2013 年的一项研究发现,丘脑底核的 DBS 可以降低晚期 PD 患者的皮质醇水平。心理压力和下丘脑-垂体-肾上腺轴的变化也存在于“新发”PD患者中。越来越多的临床试验和动物实验表明,PD 患者的 HPA 轴发生改变和不平衡,导致皮质醇水平显着升高。有趣的是,一项研究发现,帕金森病的非运动症状(例如情绪和焦虑)与头发可的松水平显着相关。毛发糖皮质激素水平反映了长期的 HPA 轴功能,并且可以提供对 HPA 轴失调在 PD 中的作用的额外见解。综上所述,虽然关于HPA轴在肠道菌群和PD中的作用的研究很少,但我们不能忽视HPA轴在PD的微生物群-肠-脑轴中的作用。
在临床上,帕金森病的主要治疗方法仍然是多巴胺能药物。目前,尚无已知的治愈帕金森病的方法。尽管越来越多的证据支持肠道微生物群在帕金森病中的作用,但基于肠道微生物群的疗法仍在研究中。本节总结了调节肠道微生物组的新兴预防和治疗干预措施(表3)。
3.1 益生元
益生元是有机物质,不被宿主消化吸收,而是选择性地促进体内有益菌的代谢和增殖,从而改善宿主健康。益生元一旦到达结肠,就会被分解和利用,促进结肠菌群的生长,在改善肠道微生态和调节脂质代谢方面发挥重要作用。不同类型的益生元包括低聚异麦芽糖、低聚果糖、低聚半乳糖 (GOS)、低聚木糖、低聚乳糖、大豆低聚糖和菊粉。虽然使用益生元治疗帕金森病的研究很少,但益生元的神经保护作用得到了验证。将GOS喂给大鼠可以提高中枢脑源性神经营养因子(BDNF),N-甲基-D-天冬氨酸受体亚基(NMDAR)和D-丝氨酸的表达。在另一项实验中,新生儿益生元(BGOS)补充剂增加了成年大鼠海马中突触素,GluN 2A亚基和BDNF蛋白的水平。此外,据报道,低聚木糖可以通过减少小胶质细胞通过肠脑轴的活化来有效恢复肥胖胰岛素抵抗大鼠的认知功能。乳果糖还被发现有助于修复肠道屏障损伤、改善肠道微生物群失衡和减少中风小鼠的中风后炎症反应。这些研究的结果表明,益生元可能在改善神经功能方面发挥重要作用。此外,益生元可以改善免疫功能并调节排便习惯。我们推测这可能与帕金森病炎症和胃肠道功能障碍的改善有关。一项临床试验发现,含有益生元纤维的发酵乳在改善帕金森病患者的便秘方面优于安慰剂。在PD纹状体鱼藤酮模型小鼠中,发现益生元纤维可以部分缓解鱼藤酮引起的运动和非运动问题。此外,它恢复了PD小鼠纹状体多巴胺转运蛋白的水平,表明其神经恢复特性。综上所述,益生元相关机制可能在于改善肠道菌群组成,改善肠道屏障功能,对菌群-肠-脑轴的调节显示出潜在的有益作用。
3.2 益生菌
益生菌是可以改善肠道菌群平衡的微生物,从而对宿主产生有益作用。大多数现有研究报告称,益生菌的给药具有神经保护作用并缓解了认知障碍。益生菌可以通过神经递质水平下降、慢性炎症、氧化应激和NDD细胞凋亡发挥有益作用。一项早期研究发现,定期摄入益生菌可显着改善帕金森病患者的粪便稠度和排便习惯。一项临床试验发现,益生菌混合物(嗜酸乳杆菌、两歧双歧杆菌、罗伊氏乳杆菌和发酵乳杆菌)可改善帕金森病患者的临床症状并减少炎症和氧化反应。体外实验发现,益生菌(乳酸菌和双歧杆菌)抑制帕金森病患者炎性细胞因子和ROS的产生。根据临床研究,有证据表明,长期服用益生菌可保护多巴胺神经元并改善PD小鼠的运动功能障碍。在 6-羟基多巴胺诱导的 PD 大鼠模型中,益生菌的给药可以改善旋转行为、认知功能、脂质过氧化和神经元损伤。在另一项实验中,发现益生菌混合物可以保护多巴胺能神经元免受 MPTP 或鱼藤酮暴露引起的神经毒性作用。体内和体外实验表明,SLAB51是一种新型益生菌,可以调节BDNF通路,提高神经保护蛋白水平,减少神经元死亡蛋白。因此,验证了益生菌的神经保护作用。此外,在鱼藤酮诱导的 PD 斑马鱼模型中,益生菌(长双歧杆菌 BB536 和鼠李糖乳杆菌 HN001)被发现具有改善游泳性能和减少氧化应激的趋势。有趣的是,据报道,益生菌枯草芽孢杆菌可以防止秀丽隐杆线虫模型中的α-syn聚集。因此,益生菌可以被认为是PD受试者的新兴治疗方法。
3.3 FMT的
FMT是指以特殊的方式将功能性细菌从健康个体的粪便转移到患者的肠道,以调节肠道微生物群。FMT的目标是恢复肠道微生物群的健康多样性,并为肠道内外的某些疾病提供成功的治疗。最近,FMT 也被认为是治疗 NDD 的潜在疗法,尤其是 PD。Kuai等人发现,PD患者接受FMT后,Blautia和Prevotella的丰度增加,而拟杆菌的丰度急剧下降,PAC-QOL评分和Wexner便秘评分显著降低。Huang 等人发现,在接受 FMT 治疗后,便秘和震颤得到有效缓解。此外,Xue 等人发现 FMT 缓解了 PD 患者的运动和非运动症状,结肠 FMT 比鼻肠道 FMT 更可取。向GF小鼠口服特定微生物代谢物可促进神经炎症和运动症状,同时,用PD患者的粪便定植α-syn过表达小鼠会恶化动物的身体损伤。在MPTP诱导的PD小鼠中,发现FMT可以减少肠道微生物的生态失调,减少粪便SCFA,减轻身体损伤,并增加纹状体DA和5-HT水平。这些结果表明,健康受试者的粪便FMT可以改变肠道的微生态,从而对PD受试者表现出治疗效果。
帕金森病治疗的难治性,特别是迄今为止的晚期帕金森病,需要更好地探索基于多巴胺能治疗以外的新策略。毋庸置疑,肠道菌群相关发病机制已被凸显,并成为药物研发的灯塔。尽管高通量测序、GF动物和GMT等技术的进步使肠道微生物群的深入研究成为可能,但由于肠道微生物群之间相互作用的复杂性以及相对影响因素,肠道微生物群与PD之间的关联仍然错综复杂。本文从体液通路、细胞免疫通路和神经元通路的角度总结了肠道菌群相关机制的潜力。许多研究已经从这些不同的角度阐明了潜在的机制。这似乎是一个合理的假设,即 α-syn 可能在肠道菌群失调诱导的肠道中启动,然后通过多种途径(例如迷走神经途径)以“朊病毒样”方式转运到中枢神经系统中。然而,我们仍然认为肠道菌群与帕金森病之间的关联远比“双向”复杂得多,它必须是“多向的”,这需要进一步研究。到目前为止,针对帕金森病的肠道微生物群相关策略在临床环境中的实际应用还有很长的路要走。未来的研究应重点关注以下问题:i)阐明肠道原始α-syn进入大脑的传递机制。如何干预这样的交付过程(预防PD)?ii) 除α-syn相关机制外,肠道菌群失调是否涉及其他与PD相关的致病因素(如KP相关脂溶性小分子神经毒素)?iii) 开发低成本、低侵袭、高特异性的基于肠道菌群的 PD 生物标志物是必不可少的。iv) 需要在大型动物(如非人灵长类动物)中建立 GF 动物模型。v) 实施精心设计的GMT、益生元和益生菌临床试验。因此,人们非常期待通过全面而严谨的实验设计进行更多研究。
https://blog.sciencenet.cn/blog-41174-1417300.html
上一篇:氧化还原状态和健康的稳态控制
下一篇:基因改造人脑类器官模拟脑部疾病用于药物测试